Kp a meghatározására használt mozaikszó egy egyensúlyi állandó részleges nyomások tekintetében. Ez az állandó például az atm egység egyensúlyi állapotának gáznemű résztvevőinek értékeivel működik.

A gáznemű komponensekkel végbemenő kémiai reakciót ábrázoló egyenlet
Ebben az egyenletben minden résztvevő gáz halmazállapotú, tehát amikor egy részt vevő gáznak a parciális nyomás a keverékben, azt a pX rövidítés jelöli.
A kémiai egyensúlyi egyenlet felállításakor (koncentráció szempontjából) a termékeket a számlálóba, a reaktánsokat a nevezőbe kell helyezni:
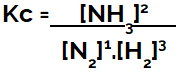
Az ammóniaképződés egyensúlyának Kc kifejeződése
kifejezése nyomásban kifejezett egyensúlyi állandó (Kp) mintáját követi Kc, azaz a reagensek parciális nyomása a nevezőben, a termékek parciális nyomása pedig a számlálóban található:
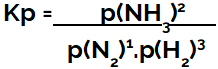
Az ammóniaképződés egyensúlyának Kp kifejezése
Megfigyelés: Ha a reakcióegyenlet a kémiai egyensúly ne jelenítsen meg semmilyen gáznemű résztvevőt, akkor nem fog automatikusan megjelenni Kp.
Példa: (PUC-MG) A reakcióhoz: 2 CO
(g) + O2(g)? 2 CO2(g), a CO parciális nyomásai(g) ez a2(g) egyensúlyban 0,2 atm, illetve 0,4 atm. A rendszer teljes nyomása 1,4 atm. Az értéke Kp mert a reakció:a) 56.2
b) 40,0
c) 35.6
d) 28.4
e) 25.6
A gyakorlat által szolgáltatott adatok a következők:
Szén-monoxid parciális nyomás (pCO) = 0,2 atm;
A szén-monoxid parciális nyomása (pO2) = 0,4 atm;
Teljes nyomás = 1,4 atm;
A rendszer Kp-jének meghatározásához a következő lépéseket kell végrehajtanunk:
1. lépés: Határozza meg a szén-monoxid parciális nyomását (pCO2).
Ehhez ne feledje, hogy a teljes nyomás (pt) az összes parciális nyomás összege:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4-0,2-0,4 = pCO2
pCO2 = 0,8 atm
2. lépés: Határozza meg a gyakorlat Kp értékét!
Ehhez csak használja a Kp egyensúlyi állandó kifejezésében szereplő értékeket:
Kp = (pCO2)2
(pCO)2.(por2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Írta: Én. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm


