Az ozmózis a víz mozgása, amely a sejtek belsejében egy félig áteresztő membránon keresztül zajlik.
Ebben a folyamatban a vízmolekulák kevésbé koncentrált közegből koncentráltabb közegbe kerülnek.
Ezért az ozmózis a membrán két oldalának kiegyensúlyozására szolgál, aminek következtében az oldott anyagban gazdag közeg oldószerrel, azaz vízzel hígul.
Hogyan történik az ozmózis?
Az ozmózis passzív transzportnak tekinthető, akárcsak a membránon keresztül történő áthaladás nincs energiapazarlás.
Az ozmózis folyamán az oldószerként szolgáló víz általában áthalad a féligáteresztő membránon az oldat koncentrációjának kiegyensúlyozása érdekében. Ezt a műveletet addig hajtják végre, amíg az ozmotikus nyomás stabilizálódik.
Ezért a víz a kevésbé koncentrált régióból a koncentráltabbba, természetesen.
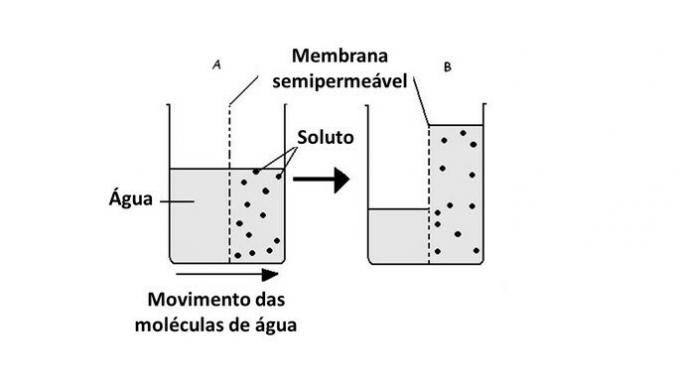
A víz egyik közegből a másikba történő áthaladását a sejtekben végzik a membránban lévő fehérjék szállítása, az akvaporinok. Így az ozmózis akkor lép fel, amikor a sejt külső és belső környezete között különbség van a koncentrációban.
Az ozmózis eredményét felhasználják az állati és növényi sejtek tápanyagcsere folyamataiban.
Olvasson erről is Passzív szállítás és Aktiv szállitás.
Hipotonikus, izotóniás és hipertóniás oldat
Mint láttuk, az ozmózisos folyamat célja az oldatok koncentrációjának kiegyenlítése, amíg ki nem áll az egyensúly. Erre a következő típusú megoldások állnak rendelkezésünkre:
- hipertóniás megoldás: nagyobb ozmotikus nyomást és oldott anyag koncentrációt mutat.
- hipotonikus megoldás: alacsonyabb ozmotikus nyomást és oldott anyag koncentrációt mutat.
- izotóniás oldat: az oldott anyag koncentrációja és az ozmotikus nyomás megegyezik, ezáltal elérve az egyensúlyt.
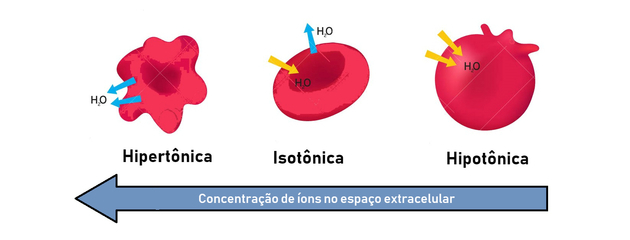
Ezért az ozmózis a hipertóniás (koncentráltabb) és a hipotonikus (kevésbé koncentrált) módszer között jön létre az egyensúly kialakításához.
az ozmózis példái
A sejtekben a plazmamembrán egy lipid kettős réteg által létrehozott burok, amely akadályozza a víz mozgását a sejtben. Vannak azonban a szerkezetére specializálódott fehérjék, az akvaporinok, amelyek csatornákként működnek, amelyek megkönnyítik a vízmolekulák átjutását.
Hipertóniás környezetben a sejtek hajlamosak zsugorodni, amikor elveszítik a vizet. Másrészt a hipotonikus közegbe helyezett sejt addig duzzadhat, amíg meg nem törik, mivel a sejtbe víz mozog.
Lásd alább, hogyan fordul elő az ozmózis az állati és növényi sejtekben.
Oszmózis állati sejtekben
amikor a állati sejta vörösvértestekhez hasonlóan különböző koncentrációjú közegeknek vannak kitéve, a víz mozgása a sejtben a következőképpen történik:
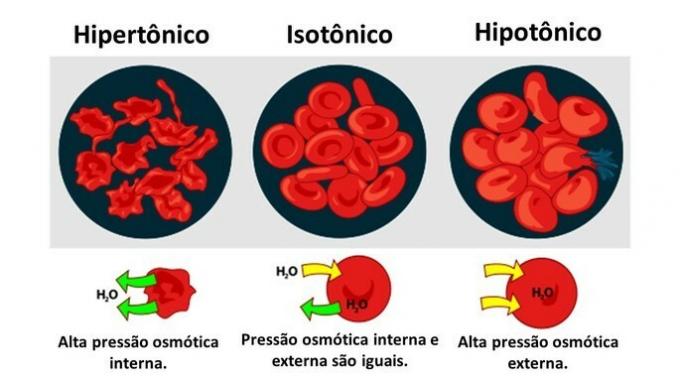
Ha a közeg gazdag oldott anyagban, a citoplazma szempontjából hipertóniás oldatban a sejtek vizet veszítenek és elsorvadnak.
Ha a táptalajban kevés az oldott anyag, egy hipotóniás oldat, a vízmolekulák hajlamosak bejutni a sejtbe, és bár a membrán ellenálló, mennyiségétől függően zavarok léphetnek fel.
Növényi sejt ozmózis
A víz mozgása a növényi sejtekben a sejtes vakuola és az extracelluláris környezet között zajlik.
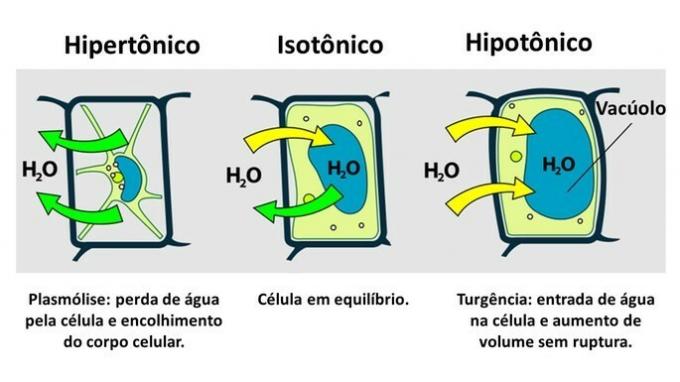
A növényi sejt a plazmamembránon kívül nagyon ellenálló sejtfala van, amelyet cellulóz alkot.
Ezért az állati sejttől eltérően a növényi sejt ellenáll a rendellenességeknek, amikor hipotóniás környezetbe kerül, ahol a víz hajlamos bejutni a sejtbe. A sejt megduzzad, növeli a térfogatát, de a sejtfal megakadályozza a repedést.
A hipertóniás környezetbe beillesztett növényi sejt vízveszteségét plazmolízisnek nevezzük. Másrészt a víz bejutását a vakuolába, amikor a sejt hipotóniás közegben van, turgornak nevezzük, amikor megnő a sejtek térfogata.
Hogyan befolyásolja az ozmotikus nyomás az ozmózist?
Oldott anyag minden olyan anyag, amelyet oldószerben hígíthatunk, például vízben oldott cukor. Míg az ozmotikus nyomás a víz mozgásának nyomása.
Mivel az ozmózis egy olyan folyamat, amely a legkevésbé koncentrált (hipotóniás) és a legkoncentráltabb (hipertonikus) közeg között egyensúly keresése, az ozmotikus nyomás a rendszerre gyakorolt nyomás, amely megakadályozza az ozmózis bekövetkezését természetesen.
Ezért minél nagyobb a koncentráció különbség a hipertóniás és a hipotonikus közeg között, annál nagyobbnak kell lennie az ozmotikus nyomásnak, amelyet a koncentráltabb oldatra kell alkalmazni az ozmózis elkerülése érdekében.
Tudj meg többet ozmotikus nyomás.
Mi a fordított ozmózis és hogyan működik
A fordított ozmózis a víz áthaladása az ozmózissal ellentétes irányba. Így a víz koncentráltabb oldatból kevésbé koncentrált oldatba kerül.
A reverz ozmózis a természetes ozmotikus nyomásnál nagyobb nyomás alkalmazásával megy végbe.
Mivel a féligáteresztő membrán csak az oldószer (tiszta víz) átengedését teszi lehetővé, az oldott anyagokat visszatartja.
A reverz ozmózis példája a sós víz átalakítása édesvízgé a sótalanítási eljárással.
Tudj meg többet fordított ozmózis.
Különbség az ozmózis és a diffúzió között
A diffúzió a vízben oldott gázok és oldott anyagok nagyon kis molekuláinak áthaladása a plazma membrán. Ebben az esetben az oldott molekula a koncentráltabb tápközegből a kevésbé koncentrált közegbe vált. Koncentrációs gradiens mentén mozognak, és elterjednek a rendelkezésre álló térben.
A megkönnyítette a diffúziót olyan anyagok átjutása a membránon keresztül, amelyek nem oldódnak fel a lipidekben, a lipid kettős réteget átjáró fehérjék segítségével.
Az ozmózishoz hasonlóan a diffúziót is a passzív szállítás, mivel a koncentráció gradiens javára történik.
Kíváncsiság
A "ozmózis útján történő tanulás" kifejezést széles körben használják azok a hallgatók, akik új tartalmat szeretnének megtanulni anélkül, hogy tanulnának, vagyis erőfeszítések nélkül.
Olvassa el:
- Oldott anyag és oldószer
- Nátrium- és káliumszivattyú
- Szelektív permeabilitás
