A szénhidrogének csak szén és hidrogén által képzett vegyületek, általános képlettel: CxHy.
Nagy mennyiségű anyagról van szó, amelyek közül a legismertebb az olaj és a földgáz alkotóeleme.
A szénhidrogén gerincét szén alkotja, és a hidrogénatomok viszont kovalens kötéssel kötődnek össze.
Széles körben használják őket a vegyiparban, nélkülözhetetlenek a kőolajszármazékok: többek között üzemanyagok, polimerek, paraffinok előállításához.
A szénhidrogének tulajdonságai
| molekuláris kölcsönhatás | Gyakorlatilag nem poláros vegyületek, és molekuláikat indukált dipólus kapcsolja össze. |
|---|---|
| Olvadáspont és forráspont | Alacsonyak a poláris vegyületekhez képest. |
| összesítési állapotok |
|
| Sűrűség | Kisebb sűrűségűek, mint a víz. |
| Oldékonyság | Oldhatatlanok vízben és nem poláros anyagokban. |
| Reakcióképesség |
|
A szénhidrogének osztályozása
Ami a fő szénlánc formáját illeti, a szénhidrogének az alábbiakba sorolhatók:
alifás szénhidrogének
Nyílt vagy aciklusos szénláncok alkotják, amelyek terminális szénnel rendelkeznek.
- alkánok
- alkének
- Alkynes
- Alkadiének
Példa:
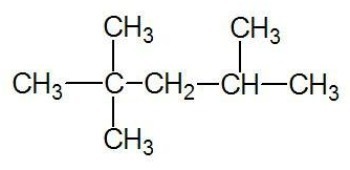
Lásd még: szénláncok
Ciklikus szénhidrogének
Zárt vagy ciklikus szénláncok alkotják, amelyek nem tartalmaznak terminális szénatomot.
- Ciklánok
- Ciklusok
- kerékpárosok
- Aromatikák
Példák:
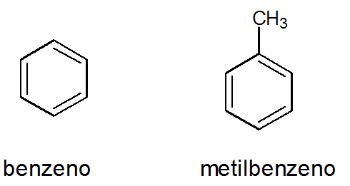
Lásd még: benzol
Ami a szénláncok kötéseit illeti, legyenek azok egyszeres, kettős vagy hármas:
Telített szénhidrogének
A vegyületeket a szén- és hidrogénatomok közötti egyszeres kötések alkotják.
- alkánok
- Ciklánok
Példa:
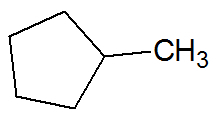
telítetlen szénhidrogének
A képződött vegyületek kettős vagy hármas kötéssel rendelkeznek a szénatom és a hidrogénatom között.
- alkének
- Alkynes
- Alkadiének
- Ciklusok
- kerékpárosok
- Aromatikák
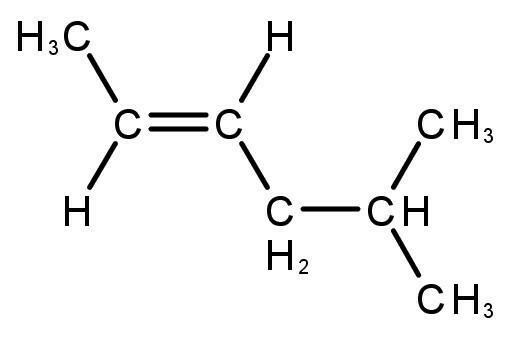
Olvasson erről is:
- Kémiai kötések
- Szerves kémia
- Szerves funkciók
Elnevezéstan
A szénhidrogének nómenklatúráját a következő kifejezések határozzák meg:
| PREFIX | KÖZVETÍTŐ | SUFFIX |
|---|---|---|
| Jelzi a láncban jelenlévő szénatomok számát. | A stringben található link típusa. | A funkcionális csoport meghatározása. |
| PREFIX | KÖZVETÍTŐ | SUFFIX | ||
|---|---|---|---|---|
| 1C | TALÁLKOZOTT | Csak egyetlen link | AN | O |
| 2C | ET | |||
| 3C | TÁMASZT | kettős kötés | EN | |
| 4C | DE | |||
| 5C | PENT | két kettős kötés | DIEN | |
| 6C | HEX | |||
| 7C | HEPT | hármas link | BAN BEN |
|
| 8C | OKTÓBER | |||
| 9C | NEM | Két hármas link | DIIN | |
| 10C | DECEMBER |
Példák
Kövesse a szénhidrogén nevek kialakulását:
| Etán |
- Előtag: ET, amely 2 szénnek felel meg.
- Közvetítő: AN, amely megfelel az egyes linkeknek.
- Utótag: O, amely megfelel a szénhidrogén funkciónak.
Nézze meg a többi példát:
| Propán | |
| Etén | |
| Etino | |
| propadién |
Bizonyos esetekben meg kell jelölni a kettős vagy hármas kötés helyzetét. A számozásnak a hivatkozás legközelebbi végétől kell kezdődnie.
| 1,3-butadién | |
| 1-butin |
További információ itt::
- Bután
- Metán
A szénhidrogének típusai
Ellenőrizze a szénhidrogének fő típusait, jellemzőit és az alkalmazott vegyületeket:
alkánok
Nyílt szénláncú szénhidrogének, amelyek szén- és hidrogénatomok között egyszeres kötések vannak, általános képletük ÇnemH2n + 2.
Alkánok jellemzői
- Parafineknak vagy paraffineknak is nevezik őket.
- A természetben megtalálhatók a földgázban és az olajban.
- Üzemanyagként használják: főzőgáz, benzin, dízelolaj stb.
Példák alkánokra

alkének
Nyílt szénláncú szénhidrogének és kettős kötésűek, általános képletük ÇnemH2n.
Alkének jellemzői
- Olefineknek, alkéneknek vagy etilénes szénhidrogéneknek is nevezik őket.
- Ipari úton nyerik a kőolajban lévő alkánok krakkolásakor.
- Nyersanyagként használják az iparban: műanyagok, színezékek, robbanóanyagok stb.
Példák alkénekre

Alkynes
Kettős kötésű nyílt szénláncú szénhidrogének, amelyek általános képlete ÇnemH2n-2.
Alkynes jellemzői
- A hármas kötés miatt reaktívabbak, mint az alkánok és az alkének.
- A 14 szénatomot meghaladó alkinek szilárdak.
- A leggyakrabban használt alkin az acetilén, amelyet általában szintetikus kaucsuk, textilszálak és műanyagok gyártásához használnak.
Példák alkinokra

Alkadiének
Ezek nyílt szénláncú szénhidrogének és két kettős kötés vannak jelen, amelyek általános képlete ÇnemH2n-2
Az alkadiének jellemzői
- Diéneknek vagy diolefineknek is nevezik
- A természetben terpénekben találhatók, amelyeket esszenciális gyümölcsolajokból nyernek ki.
- A legismertebb vegyület az izoprén, amely a természetes kaucsukban és az illóolajokban található.
Példák alkadiénekre

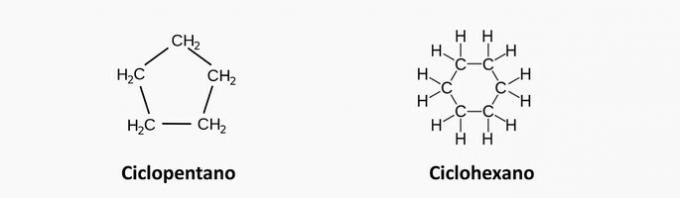
Ciklánok
Zárt láncú szénhidrogének, amelyek szén- és hidrogénatomok között egyszeres kötések vannak, általános képletük ÇnemH2n.
Cyclan jellemzői
- Cikloalkánoknak vagy cikloparaffinoknak is nevezik őket.
- Instabilak, ha nagy nyomásnak vannak kitéve.
- A 6-nál több szénatomot tartalmazó láncok stabilak, míg az 5-nél kevesebb szénatomot tartalmazó láncok reaktívak.
Példák ciklánokra

Ciklusok
Ezek kettős kötésű zárt láncú szénhidrogének, amelyek szerkezeti képlete a ÇnemH2n-2.
A ciklének jellemzői
- Cikloalkéneknek is nevezik őket.
- A 3-5 szénatomos vegyületek instabilak.
- Általában a földgázban, az olajban és a kőolajban találhatók.
Példák ciklénekre
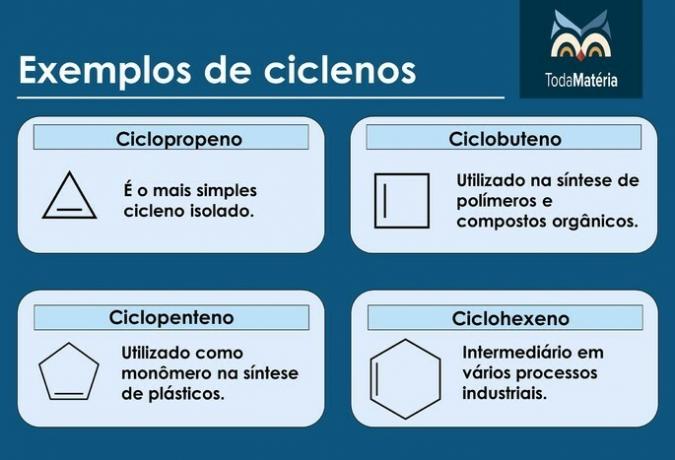
kerékpárosok
Zárt láncú szénhidrogének hármas kötés jelenlétében, amelynek szerkezeti képlete ÇnemH2n-4.
Kerékpáros jellemzők
- Más néven cikloalkinek vagy cikloalkinek.
- Ezek ciklikus és telítetlen szénhidrogének.
- A hármas kötés miatt instabilak, a természetben nem találhatók meg.
Példák a ciklinekre

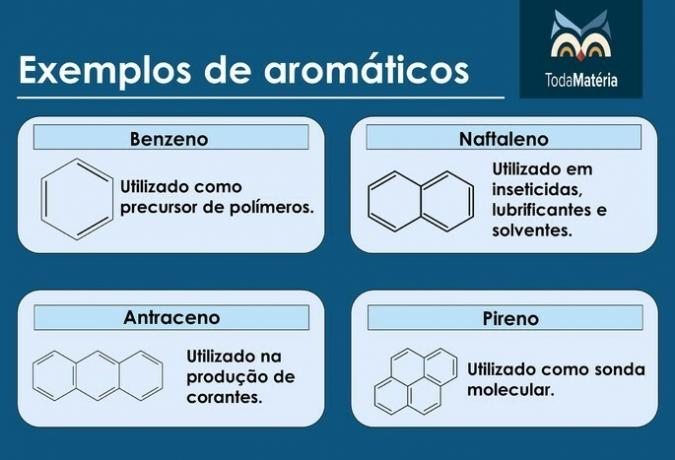
Aromatikák
Zárt láncú szénhidrogének váltakozó egyszeres és kettős kötésekkel.
Az aromák jellemzői
- Arénának is nevezik őket.
- Telítetlen vegyületek, mivel 3 kettős kötésük van.
- Legalább egy aromás gyűrűből állnak.
Példák aromás anyagokra
- Petróleum
- olajfinomítás
- Acetilén
Szénhidrogén összefoglalás
| Foglalkozása | Általános képlet |
Jellemzők |
|---|---|---|
| alkán | Nyitott lánc egyszerű linkekkel. |
|
| alkén | Nyitott lánc kettős kötéssel. | |
| alkin | Nyitott lánc hármas kötéssel. | |
| alkadién | Nyitott lánc két kettős kötéssel. | |
| Ciklánok | Zárt lánc egyszerű csatlakozásokkal. | |
| Ciklusok | Zárt lánc kettős kötéssel. | |
| kerékpárosok | Zárt lánc hármas kapcsolattal. | |
| Aromás | Változó | Zárt lánc váltakozó egyszeres és kettős kötésekkel. |
Gyakorlatok a szénhidrogénekről
1. (UEMA) LPG (Liquefied Petroleum Gas), közismert nevén főzőgáz üzemanyag nem megújuló kövület, amely egyik napról a másikra elfogyhat, ha nem használják tervezéssel és anélkül felesleg. Egyéb gázok mellett C-propánból áll3H8, bután C4H10 és kis mennyiségű propilén C3H6 és a butén C4H8. Ezeket a szerves vegyületeket szénhidrogénekként osztályozzák, amelyek hasonlóságokkal és eltérésekkel rendelkeznek közöttük. A szénatomok közötti kötés típusa és a fenti vegyületek szénláncának osztályozása alapján megállapítható, hogy:
a) a telítetlen vegyületek propán és bután.
b) a telítetlen vegyületek propén és butén.
c) a telítetlen vegyületek propén és bután.
d) a vegyületek homociklusos láncokkal rendelkeznek.
e) a vegyületek heterociklusos láncokkal rendelkeznek.
B) alternatíva: a telítetlen vegyületek a propén és a butén.
a) Rossz. Ezeknek a vegyületeknek nincs telítetlenségük, kötéseik egyszerűek.
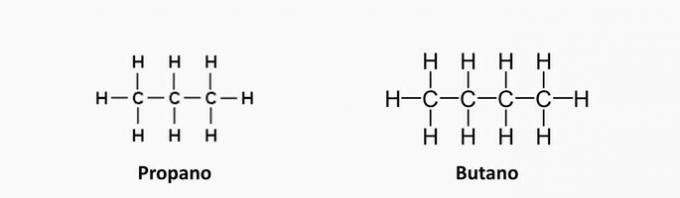
b) Helyes. Az "en" kifejezés kettős kötések jelenlétét jelzi a vegyületekben.

c) ROSSZ. A butánnak nincs telítetlensége.

d) ROSSZ. Ezek a láncok zárva vannak, és a szénatomokat egyetlen kötések kötik össze.
e) Rossz. Ezeknek a láncoknak heteroatomja van, például oxigén és nitrogén.

2. (Uel) A (C) képletű szénhidrogének egyike5H12 szénláncú lehet:
a) telített ciklikus.
b) heterogén aciklusos csoport.
c) elágazó ciklikus.
d) telítetlen nyitott.
e) nyitott elágazású.
E) alternatíva) nyitott elágazású.
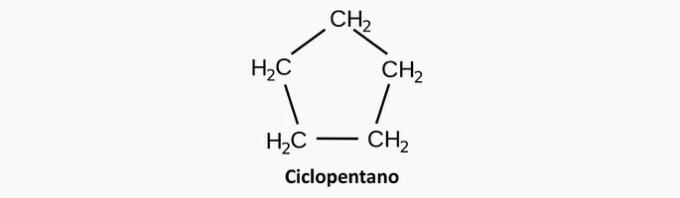
a) Rossz. Telített ciklikus vegyület felel meg egy ciklánnak, amelynek képlete CnemH2n.
Példa:
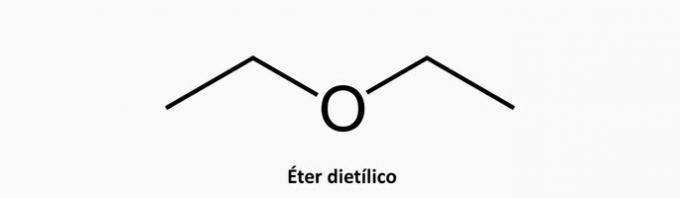
b) ROSSZ. A heterogén aciklusos vegyületben a láncban lévő interkalált szén mellett egy másik elem is jelen van.
Példa:
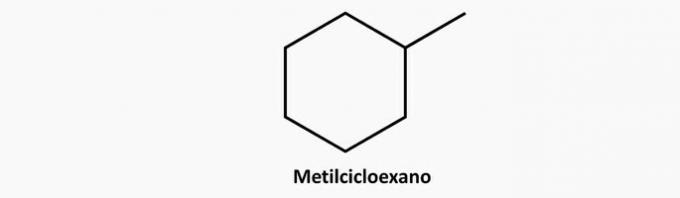
c) ROSSZ. Az elágazó láncú ciklikus vegyületnek C képlete vannemH2n.
Példa:
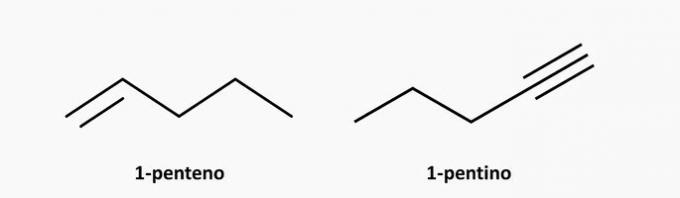
d) ROSSZ. Telítetlen nyílt láncú vegyület lehet alkén vagy alkin, amelynek képlete C, ill.nemH2n és CnemH2n-2.
Példák:
e) Helyes. A nyílt láncú elágazó vegyület egy alkán, amelynek képlete CnemH2n + 2. 5 szénatomot és 12 hidrogént tartalmazó vegyület izopentán lehet.
Példa:
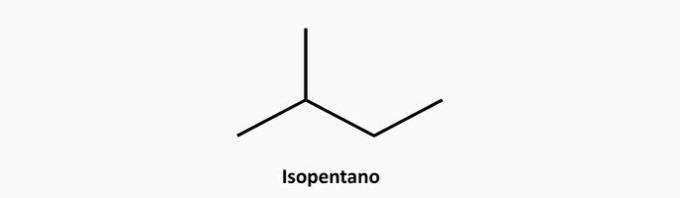
3. (PUC) Az alkinek szénhidrogének:
a) telített alifás anyagok.
b) telített aliciklusok.
c) kettős kötésű telítetlen alifás vegyületek.
d) hármas kötésű telítetlen aliciklusok.
e) hármas kötésű telítetlen alifás vegyületek.
E) alternatíva hármas kötésű telítetlen alifás vegyületek.
a) Rossz. A nyílt láncú és egyszeresen kötött vegyületek alkánok.
Példa:

b) ROSSZ. Az egyszeres kötésű ciklikus vegyületek ciklánok.
Példa:
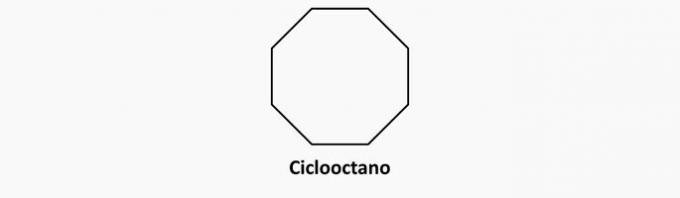
c) ROSSZ. A nyílt láncú és a kettős kötésű vegyületek alkének.
Példa:
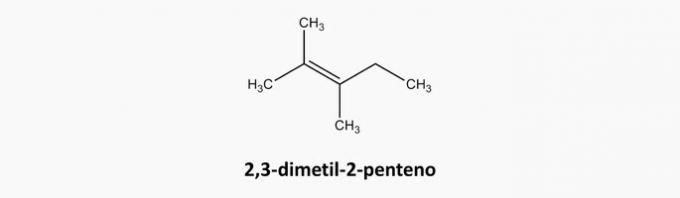
d) ROSSZ. A ciklikus és hármas kötésű vegyületek ciklinek.
Példa:
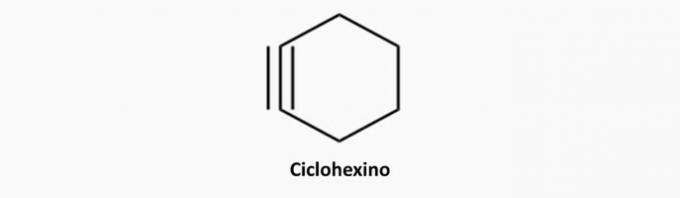
e) Helyes. Az alkinek nyitott láncú és hármas kötésű vegyületek.

Szeretné folyamatosan tesztelni tudását? Ügyeljen arra, hogy ellenőrizze ezeket a listákat:
- Gyakorlatok a szénhidrogénekről
- Szerves kémiai gyakorlatok
- Gyakorlatok a szerves funkciókról
