A termikus egyensúly, más néven termodinamikai egyensúly, amikor két test vagy anyag eléri a azonos hőmérsékletű.
Ez a termodinamikai koncepció összefügg a spontán hőátadással (hőenergia), amely két érintkező test között történik.
Ebben a folyamatban a melegebb test átadja a hőt a hűvösebb testnek, amíg mindkettő azonos hőmérsékleten van.

hőátadási séma
Két test közötti energiacsere (hőenergia) a melegebb test hőenergia-vesztését és a hűvösebb test energia-nyereségét eredményezi.
Példa
Példaként megemlíthetjük a forró kávé és a hideg tej keverékét. Bár kezdeti hőmérsékletük eltérő, rövid idő alatt a legforróbb test (kávé) hőenergiát visz a leghidegebbé (tej). Így a keverék langyos lesz a hőegyensúly hatására.
Feltételezve, hogy a kávé 50 ° C-on, a tej 20 ° C-on van, a hőegyensúly akkor érhető el, ha mindkettő 35 ° C-on van.

hő terjedése
Fontos megjegyezni, hogy a hő az energiacsere, és átadása háromféle módon történhet:
- hővezetés: kinetikus energia növekedése;
- termikus konvekció: konvekciós áramok létrehozása;
- termikus besugárzás: elektromágneses hullámok segítségével.
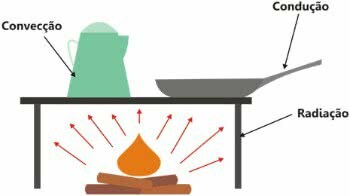
A hőterjedés típusai
Olvass tovább: hő terjedése.
Képlet
A hőmérleg kiszámításához a következő képletet kell használni:
Q1 + Q2 + Q3... = 0 vagy ΣQ = 0
Lény,
Q: hőmennyiség (testhőmérséklet)
Így tudjuk, hogy az összes hőenergia összege nulla.
O érzékelhető hő a testek hőmérséklet-változásával függ össze. Kiszámítása a következő képlettel történik:
Q = m. ç. Δθ
Hol,
Q: érzékeny hőmennyiség (mész vagy J)
m: testtömeg (g vagy kg)
ç: az anyag fajlagos hője (cal / g ° C vagy J / Kg ° C)
Δθ: hőmérséklet-változás (° C vagy K)
Olvasson erről isKalorimetriaésHő és hőmérséklet.
Felvételi vizsga gyakorlatok visszajelzéssel
1. (Mackenzie) Amikor 1,0 kg vizet (érzékeny fajlagos hő = 1,0 cal / g ° C) keverünk 70 ° C-on 2,0 kg vízzel 10 ° C-on, 3,0 kg vizet kapunk:
a) 10 ° C
b) 20 ° C
c) 30 ° C
d) 40 ° C
e) 50 ° C
C) alternatíva: 30 ° C
2. (UFP-RS) Vegye figyelembe a következő állításokat:
ÉN. Ha két test egyensúlyi állapotban van, akkor mindkettőjük hőmennyisége azonos.
II. Amikor két test hőegyensúlyban van, mindkettőjük hőmérséklete azonos.
III. A hő a hőmérséklet egyik testből a másikba történő átvitelét jelenti.
IV. A hő az átmenő energia egyik formája.
A fenti állításokból elmondható, hogy:
a) Az I., II., III. és IV
b) I, II, III helyesek
c) Az I., II. és IV
d) A II. és a IV
e) a II. és a III
A d) II. És IV
3. (FATEC-SP) Az A rendszer hőegyensúlyban van egy másik B-vel, és ez nem egy másik C-vel. Tehát azt mondhatjuk, hogy:
a) az A és a C rendszer azonos hőmennyiséggel rendelkezik.
b) A hőmérséklete eltér a B hőmérsékletétől.
c) az A és B rendszerek hőmérséklete azonos.
d) a B hőmérséklete eltér a C hőmérsékletétől, de a C hőmérséklete ugyanaz lehet, mint az A rendszerben.
e) a fentiek egyike sem.
A c) alternatíva A és B rendszereinek hőmérséklete azonos.
4. (UFV-MG) Ha két különböző anyagú test hőháztartásban van, elkülönítve a környezettől, akkor azt lehet mondani, hogy:
a) a legforróbb a legkevesebb tömegű.
b) az érintkezés ellenére hőmérsékletük nem változik.
c) a legforróbb a leghidegebb hőt biztosítja.
d) a leghidegebb biztosítja a meleget a legforróbbnak
e) hőmérsékletük a sűrűségüktől függ.
B) alternatíva) az érintkezés ellenére a hőmérsékletük nem változik.
5. (UFScar-SP) Két A és B test, m tömeggelA ban benB, kezdetben t hőmérsékleten vannakA és teB, illetve t-velA tB. Egy adott pillanatban termikus érintkezésbe kerülnek. A hőegyensúly elérése után:
a) t’a> t’b
b) t’a c) t’a = t’b
d) n.d.a.
C) t’a = t’b alternatíva
Lásd még:Egyensúly a fizikában.



