Amikor kimondjuk az „egyensúly” szót, a végtelenségig megmaradt tárgy jut az eszembe. Ez azonban csak egyfajta egyensúly, az úgynevezett „Statikus egyensúly”.
Van még a „Dinamikus egyensúly”. Abban, amint a neve mondja, egyetlen pillanat sincs, amelyben a kérdéses tárgy vagy jelenség még mindig ott lenne. Például, hogy megértse, nézze meg az alábbi ábrát, és vegye figyelembe, hogy a tartályba eső vízmennyiség megegyezik a belőle kifolyó vízmennyiséggel, állandó szinten tartva a vízszintet. Ebben az esetben azt mondjuk, hogy van egy dinamikus egyensúly, mozgásban lévő egyensúly.

Ez a fajta egyensúly fordul elő reverzibilis reakciók, vagyis azokban a reakciókban, amelyek mindkét irányban jelentkeznek. Ugyanakkor, amikor a reaktánsok molekulái átalakulnak termékekké, a termékek molekulái egymással reagálva képezik a reagenseket. A reakció visszafordíthatóságát mindkét irányba mutató nyilak jelzik:
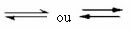
Amikor a közvetlen reakció (a termékek képződésének) fejlődési sebessége megegyezik a inverz reakció (reaktánsok képződése) állandó hőmérsékleten azt jelenti, hogy a reakció elérte egyensúlyát kémiai. És olyan reakciók esetén, amelyekben csak molekulák vannak jelen a reagensekben és a termékekben, a molekuláris egyensúly.
Az alábbiakban a hidrogéngáz (H2) és jódgáz (I2), hidrogén-jodid (HI) gáz képződéséhez:
A reakció kezdetén a közvetlen reakció kifejlődésének sebessége nagyobb volt, miután a reaktánsok összes koncentrációja maximális volt, és a termékeké nulla volt. Tehát a fordított reakció kialakulásának sebessége is nulla volt.
Azonban idővel a hidrogén- és jódgázok reakcióba lépnek, így keletkezik a termék. Ily módon a reagensek koncentrációja csökkenni kezd, és fejlődésük sebessége is csökken.
A termékek koncentrációjának növekedésével és a reagensek koncentrációjának csökkenésével az inverz reakció fejlődési sebessége növekszik. Ha a hőmérsékletet állandó értéken tartjuk, eljön az az idő, amikor a két fejlődési sebesség ugyanaz marad, ami azt mutatja, hogy a reakció kémiai molekuláris egyensúlyba került.
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm