Az oxidáció az a kémiai reakció, amelyben az atomok, ionok vagy molekulák elveszítik az elektronokat. Emellett az oxidáció (nox) számának növekedését is okozza.
Az oxidáció kifejezést eredetileg olyan reakciók jelölésére hozták létre, amelyekben az oxigén volt a reagens. Megállapították azonban, hogy egyes esetekben ezek az elemek hiányában következtek be. Mivel a kifejezés már széles körben ismert volt, továbbra is használatban volt.
Az oxidációs reakciók egyidejűleg zajlanak le a redukciós reakciókkal. Ezért redoxnak hívják őket, amelyben az elektronok átkerülnek.
Redox-reakciókban az oxidálószer az, amely elfogadja az elektronokat, és redukción megy keresztül. A redukálószer elveszíti az elektronokat és oxidálódik.
Oxidációs példák
Vas oxidációja
A rozsda a vas oxidációja. Minden fém oxidálódhat. A fémek levegővel és vízzel való érintkezése miatt következik be. Kezdetben a korrózió amely a fém kopása, az oxidáció következtében. Ezután képezi a rozsda.
Lásd a reakciót redox rozsda kialakulásához:
- Fe (s) → Fe2+ + 2e-. Ebben a szakaszban a vas két elektronot veszít, oxidáción megy keresztül
- O2 + 2 H2O + 4e- → 4OH-. O redukció2
- 2Fe + O2 + 2H2O → 2 Fe (OH)2. Általános egyenlet - Fe (OH)2 A vas-hidroxid a rozsda barna színéért felelős.
A vas és az acél oxidáció elleni védelme érdekében a horganyzási technika alkalmazható. Fém cinkbevonatból áll. Ez azonban drága folyamat, egyes esetekben megvalósíthatatlanná teszi.
Így a hajók teste és a fém platformok magnézium tömböket kapnak, amelyek megakadályozzák a vas oxidációját. A magnéziumot áldozati fémnek tekintik, és kopásakor időről időre ki kell cserélni.
A festés szintén megvédi a fémet az oxidációtól, de nem annyira hatékony.

Rozsda
Olvasson erről is Rozsdamentes acél és Fémötvözetek.
Oxidáció a szerves kémia területén
A fémek mellett oxidáció is előfordulhat Szénhidrogének, különösen a alkének. A szerves oxidációnak négy formája van: égés, ózonolízis, enyhe oxidáció és energia oxidáció.
Égés
A égés egy anyag kémiai reakciója oxigénnel, amely a fény és a hő termelésében ér véget. Az oxigént oxidálónak nevezik. A szénnel rendelkező anyag az üzemanyag.
Az oxigén funkciója az üzemanyag oxidálása, ez az égés oxidáló ágense.
Az égés lehet teljes vagy hiányos. Ismerje a különbséget a két módszer között:
- Teljes égés: Akkor fordul elő, ha elegendő oxigénellátás van. A reakció végén szén-dioxid (CO2) és a víz (H2O).
- Hiányos égés: Nincs elég oxigénellátás, kialakulnak szén-monoxid (CO) és víz (H2O).
Ozonolízis
Ebben a típusú reakcióban az ózon az a reagens, amely az alkének oxidációját okozza. Az alkének kettős kötése megtörik és karbonil vegyületek képződnek, mint pl aldehidek és ketonok.
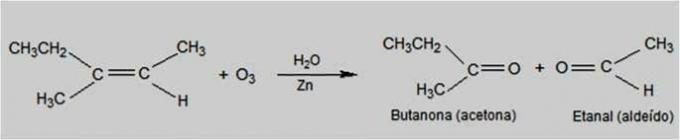
Ozonolízis reakció
enyhe oxidáció
Enyhe oxidáció akkor következik be, ha az oxidálószer olyan vegyület, mint a kálium-permanganát (KMnO4), hígított és lehűtött vizes oldatban van, semleges vagy enyhén lúgos.
Ez a fajta oxidáció a Baeyer-teszt alkalmazásával történik, amelyet az alkének és az izomer ciklánok megkülönböztetésére használnak.
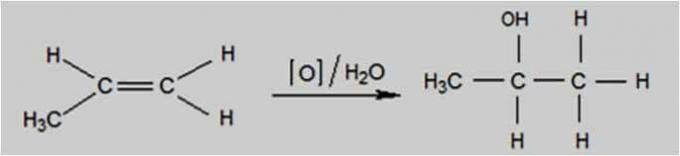
Enyhe oxidációs reakció
Energia oxidáció
Ebben a fajta oxidációban a kálium-permanganát forróbb és savasabb környezetben található, ami energikusabbá teszi a reakciót. Az energikus oxidálószerek megszakíthatják az alkének kettős kötését.
Az alkén szerkezetétől függően ketonok és karbonsavak képződhetnek.
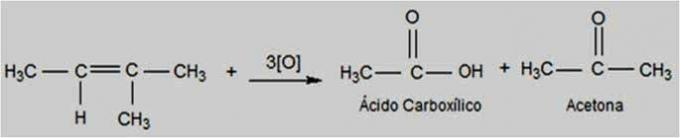
Energia oxidációs reakció
Szeretne többet megtudni? Olvasson erről is Elektrokémia.

