A kloridok azok az ionos vegyületek, amelyek az aniont tartalmazzák Cℓ-1.
A klór a 17-es vagy a 7A-családba tartozik, atomszáma megegyezik 17-vel, és a valens héjban (az atom legkülső elektronhéja) 7 elektron van. Alapján szabály az oktett, hogy stabil legyen, 8 elektronnak kell lennie ebben az utolsó héjban, és ezért még egy elektront kell fogadnia. Amikor ez megtörténik, vagyis amikor elektront kap, általában egy fémmel kötött ionkötésből, akkor kialakul az â.ion klorid (Cℓ-1), az elektront feladó fémből kation válik, és a képződött anyag ionos.
A kloridok olyan sók, amelyek egy bázis sósavval (HC2(itt)). A bázis biztosítja a kationt, a sósav pedig a kloridiont:
Általános bázis + sósav → Klorid + víz
ÇOH + HCℓ → ÇCℓ + H2O
A kloridokat mind besorolják szervetlen sók, mert vizes közegben a H-tól eltérő kationt szabadítanak fel+ és szabadítsa fel a kloridaniont, ne a hidroxilt (OH-).
A kloridok nómenklatúrája mindig ezt a szabályt követi: Klorid +de + (a klórhoz kapcsolódó elem neve). Nál nél
formálódnak a képleteid kicserélve az ion töltéseket az indexekre (az elemszimbólum jobb alsó sarkában lévő szám, amely az elem azon atomjainak számát jelöli, amelyek kötéseket hoznak létre).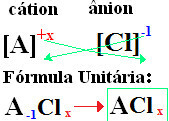
ha az index "1", akkor nem kell beírnia a képletbe, az alábbiak szerint:
Nál nél+1 Cℓ-1 → Nál nél1Cℓ1 → Nál nélC6: nátrium-klorid;
K+1 Cℓ-1 → KC6: kálium-klorid;
Itt+2 Cℓ-1→CaCℓ2: kalcium-klorid;
Ba+2 Cℓ-1→ Bitt2: bárium-klorid;
Aℓ+3 Cℓ-1→ACℓ3: alumínium-klorid.
Ugyanakkor, amint azt a szövegA csoport ionos anyagai: klorid, karbonát, nitrát és szulfát”, Mint minden ionos anyagnál, a kloridoknál sem egységes egységek vannak a természetben, mivel ionjaik kölcsönösen vonzzák egymást és kristályrácsokat alkotnak.
A klorid legfőbb példája a mindennapi életben a nátrium-klorid, NaCℓ, az étkezési só. Lásd a képződését eredményező ionkötést (amelyben a nátrium elektront ad a klórnak), és e só kristályrács alatt:
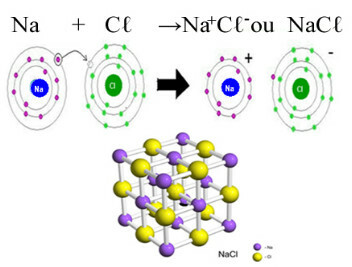
A nátrium-klorid kristályrácsában minden anion Cℓ- 6 kation Na veszi körül+ és fordítva, tehát ennek a kristályrácsnak a koordinációs száma 6.
Minden klorid szilárd anyagok környezeti körülmények között és egészen vízben oldódó, a mindennapi életünkben megtalálható leggyakoribb sók közé tartozik, tekintve, hogy közülük többen ásványvízben, ivóvízben, csapvízben, folyókban, tengerekben oldva vannak jelen mások. Kivételek között, amelyek vízben oldhatatlan kloridok, az ezüst-klorid (AgCℓ - az alábbi ábrán látható), ólom, réz és higany vegyületek.

Vízben oldhatatlan ezüst-klorid *
A Cℓ-ionok-1 az általunk bevitt kloridokból, főleg a só, hal és hús, fontosak az emberi test bizonyos funkciói szempontjából, mivel ezek a fő extracelluláris anionok, jelen vannak a lében gyomor, szabályozza a testfolyadékokat, például a víz eloszlását a testben, és fenntartja a plazma ozmotikus nyomását és semlegességét elektromos.
Hiánya szorongást, hasmenést és keringési problémákat okozhat. Feleslege vizelettel (átlagosan naponta körülbelül 4 g kloridot választ ki), izzadsággal és ürülékkel ürül.
*Kép jóváírása: Szerző: Danny S. / Kép kivonva: Wikimedia Commons
Írta: Jennifer Fogaça
Kémia szakon végzett