Kovalens kötés a magas atomok közötti kölcsönhatás egyik típusa elektronegativitás, vagyis nagy a hajlam az elektronok fogadására. Az ilyen típusú kötésben általában előforduló kémiai elemek a következők:
Hidrogén (H)
Berillium (Be)
Bór (B)
Szén (C)
Nitrogén (N)
Foszfor (P)
Oxigén (O)
Kén (S)
Fluor (F)
Klór (Cl)
Bróm (Br)
Jód (I)
a) Az érintett elemek jellege
Azok a kémiai elemek, amelyek nagy elektronegativitással rendelkeznek, és következésképpen kovalens kötéseket hajtanak végre, a következők:
Hidrogén
Ametálok
b) A kovalens kötés előfordulása
A kovalens kötésben részt vevő kémiai elemek jellegétől függően az alábbiak szerint fordulhat elő:
Két hidrogénatom között;
Nemfém atom és hidrogén között;
Azonos kémiai elem (nemfém) atomjai között;
Különböző kémiai elemek (mindkét nemfém) atomjai között.
c) Az atomok által befogadni kívánt elektronok száma
Az elektronok száma, amelyeket minden nemfém vagy hidrogénatom kötésben fogad, összefügg az oktett szabály.
Az oktett-szabály szerint az atom akkor stabil, ha nyolc vagy két elektronot szerez (csak a hidrogén esetében) a vegyértékhéjban. Ha egy atom vegyértékes héjában például öt elektron van, akkor a stabilitás elérése érdekében három elektront kell befogadnia.
MEGJEGYZÉS: A berillium és a bór az kivételek az oktett szabály alól, mivel stabilakká válnak, a vegyértékhéjban 4 és 6 elektron található.
A vegyértékes héjban lévő elektronok száma könnyen meghatározható a kémiai elemcsalád elemzésével. Az alábbi táblázatban megvan a vegyértékes héjban lévő elektronok száma, utalva arra a családra, amelyhez az elem tartozik, és az elektronok számára, amelyekre a stabilitás eléréséhez szüksége van:

d) Kovalens kötés elve
A kovalens kötéshez hasonlóan minden érintett atom hajlamos arra, hogy kötelezően elektronokat fogadjon, közöttük megoszlik a vegyértékhéjban (a magtól legtávolabbi szint) jelenlévő elektron.
A megosztás akkor következik be, amikor az atom vegyértékű héjából származó elektron ugyanazon elektronikus felhő részévé válik, amely egy másik atom vegyértékes héjából egy másik elektront vesz körül.
Például minden hidrogénatomnak elektronja van a vegyértékhéjban. Amikor két elektron ugyanazon felhő részévé válik, mindegyik hidrogénnek két vegyértékű elektronja van, vagyis stabilizálódik.
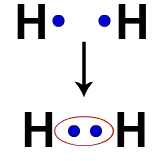
Két hidrogénatom elektronjai ugyanazt az elektronfelhőt foglalják el
e) A kovalens kötésben alkalmazott képletek
1ª) molekulaképlet
A kovalens kötésekből származó molekulákat alkotó egyes elemek atomjainak száma.
Példa: H2O
A vízmolekulában 2 hidrogénatom és 1 oxigénatom van.
2ª) szerkezeti képlet
A szerkezeti képlet a molekula szervezetének bemutatása, vagyis az atomok közötti kötéseket mutatja be. Ehhez az egyes atomok kötését képviselő kötőjeleket használjuk:
Egyszerű (?): Azt jelzi, hogy az atom vegyértékhéjából csak egy elektront osztott meg egy másik atomdal, és fordítva;
Kettős (?): Azt jelzi, hogy az atom két elektront osztott valenshéjából a másik atomdal, és fordítva;
Hármas (≡): Azt jelzi, hogy az atom vegyértékhéjából három elektront osztott meg egy másik atomdal és fordítva.
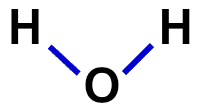
A víz szerkezeti képlete
3ª) Lewis elektronikus képlete
A Lewis elektronikus képlet a molekula szervezetét is képviseli (elektronikus képlet), de célja az elektronok atomokban való megosztásának bemutatása.
Ennek felépítéséhez elég tiszteletben tartani a szerkezeti képletben javasolt szervezetet, és a kötések minden egyes nyomát (egy-, kettős vagy hármas) kicserélni az elektronokat képviselő két golyóra.
A víz szerkezeti képletében például két egyszerű kötés van a hidrogének és az oxigén között. Így közöttük csak két gömbünk lesz, amelyeket ellipszis határol (amely az elektronikus felhőt ábrázolja).
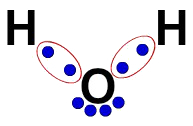
Lewis elektronikus képlete
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm
