Izomerizmus ez egy természetes jelenség, amelyben a különböző anyagoknak (a kémiai és fizikai tulajdonságok szempontjából) pontosan ugyanaz a molekulaképletük, mint a következő példában:
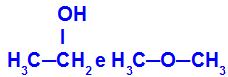
Különböző anyagok, amelyeknek molekuláris képlete azonos
Az etanol (balra) molekuláris képlete C2H6O, amely metoxietánnal is előfordul (jobbra), tehát izomerek.
Az izomerizmus típusai
→ lapos izomer
Az izomeria típusa az izomerek közötti strukturális különbségeket tanulmányozza.
A) Foglalkozása
Ez a lapos izomerizmus olyan típusa, amelyben az anyagok közötti különbség azon szerves funkciók közötti különbségen alapul, amelyekhez tartoznak. Néhány példa:
Propanon és propán:
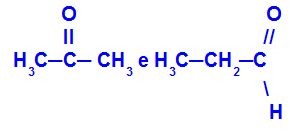
Különböző funkciókhoz tartozó izomerek
A propanon (balra) a ketoncsoportba, a propanal (jobbra) az aldehidcsoportba tartozik.
B) Börtön
Ez a lapos izomeria olyan típusa, amelyben az anyagok közötti különbség az általuk bemutatott láncok közötti különbségen alapul. Lásd egy példát:
2-metil-propán és bután
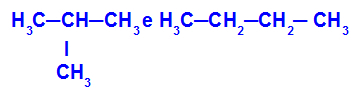
Izomerek, amelyek különböző osztályozású láncokkal rendelkeznek
A példában láthatjuk, hogy a 2-metil-propán (a bal oldalon) elágazó láncú, a bután (a jobb oldalon) pedig normális láncú.
ç) Pozíció
Ez a lapos izomerizmus olyan típusa, amelyben az anyagok közötti különbség a láncaikban jelen lévő komponens helyzetének különbségén alapul. Lásd egy példát:
1-klór-propán és 2-klór-propán
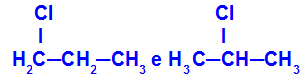
Izomerek, amelyek komponensei a lánc különböző pozícióiban vannak
A példában láthatjuk, hogy az 1-klór-propán (a bal oldalon) klórja az 1-es szénen, a 2-klór-propán (a jobb oldalon) pedig a 2-es szénen helyezkedik el.
d) Metameria vagy kompenzáció
JEGYZET: Kizárólag heterogén húrokra érvényes izomerizmus.
Ez a lapos izomerizmus olyan típusa, amelyben az anyagok közötti különbség a láncaikban jelen levő heteroatom helyzetének különbségén alapul. Lásd egy példát:
Példa: Metoxipropán és etoxietán
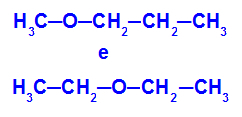
Izomerek, amelyek heteroatomjai a lánc különböző helyzeteiben vannak
A példában láthatjuk, hogy a metoxi-propánban (balra) az oxigénnek van egy gyöke, amelynek egyik oldalán az egyik, a másikon három szénatom van. Az etoxietánban (jobbra) az oxigénnek van egy gyöke, amelynek egyik oldalán két szénatom van, a másik oldalon pedig két.
és)Tautomery
A síkfüggvény izomerizmusának egy speciális esete, és csak három szerves funkcióban fordul elő:
Aldehid
keton
Enol
Ez a fajta izomeria azon a tényen működik, hogy kémiai egyensúly van egy enol és egy aldehid, valamint egy enol és egy keton között, vagyis ezek az összetevők folyamatosan átalakulnak egymásba. Lásd egy példát:
Prop-2-én-1-ol és propanon
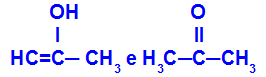
Különböző funkciókhoz tartozó izomerek
A példában láthatjuk, hogy a Prop-2-én-1-ol (a bal oldalon) az enolok, a propanon (a jobb oldalon) a ketonok csoportjába tartozik, tehát a tautoméria izomerjei.
→ Térizomerizmus
Ez egy olyan izomeria típus, amelyet a molekula térbeli elemzése határoz meg.
a) Geometriai izomerek
Ne álljon meg most... A reklám után még több van;)
Ez egyfajta térbeli izomeria, amely akkor fordul elő, ha az anyagnak a következő tulajdonságokkal rendelkező molekulái vannak:
Zárt lánc, amely két szénatomot tartalmaz, két különböző ligandummal, az alábbi példa szerint:

Zárt szerkezet geometriai izomerizmussal
Nyitott lánc, amelynek kettős kötése van a szénatomok között, és a kettős kötés mindegyikében két különböző ligandum van, mint az alábbi példában:
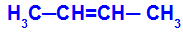
Nyitott szerkezet geometriai izomerizmussal
A geometriai izomerizmus két csoportra oszlik:
1O Csoport: cisz-transz
Akkor fordul elő, amikor az egyik szén két liganduma szigorúan megegyezik a másik szén két ligandumával, akár nyitott, akár zárt szerkezetben.
Cisz-transz izomerizmussal rendelkező anyag láncolata
Az izomert cisznek fogjuk nevezni, ha ugyanazok a ligandumok ugyanabban a síkban vannak.

Példa egy cisz izomerre
Az izomert akkor hívják transznak, amikor a különböző ligandumok ugyanabban a síkban vannak.

Példa transz-izomerre
2O Csoport: E-Z
Akkor fordul elő, amikor az egyik szén két liganduma különbözik a másik szén két ligandumától, akár nyitott, akár zárt szerkezetben.

E-Z izomerizmussal rendelkező anyag láncolata
Az izomert akkor hívják E-nek, amikor a legnagyobb atomszámú ligandumok ellentétes síkokban vannak. Az alábbi példában a bal oldali szénnél a legmagasabb atomszámú Br (35) van, a másikban oxigén van (8).
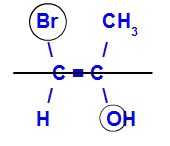
Példa egy E-izomerre
Az izomert Z-nek fogjuk nevezni, ha a legnagyobb atomszámú ligandumok ugyanabban a síkban vannak. Az alábbi példában a bal oldali szénnél a legmagasabb atomszámú Br (35) van, a másikban oxigén van (8).

Példa egy Z-izomerre
B) optikai izomer
Ez egy olyan térbeli izomerizmus, amely csak akkor fordul elő, ha az anyagnak vannak molekulái királis szén (amelynek négy különböző liganduma van) szerkezetében. A királis szénatomot tartalmazó molekula képes a fény polarizálására és elhajlítására, az alábbiak szerint:
Jobbra (jobb oldali izomer)
Balra (mozgásirányú izomer)
Az optikai aktivitású vegyületeknek mindig van aktív izomerek (optikai antipódoknak nevezzük) és inaktív izomerek (két aktív izomer keveréke, racém elegynek nevezett keverék).
A következő képlettel meghatározhatjuk a királis szénatomot tartalmazó vegyületek aktív (IOA) és inaktív (IOI) izomerjeinek számát:
IOA = 2nem
IOI = 2nem
2
Az alábbiakban bemutatunk egy vegyületet, amelynek geometriai izomerizmusa van:
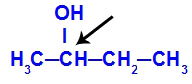
A királis szén a bután-2-olban található
A bután-2-ol szerkezete a következő ligandumokkal rendelkezik:
Metil (CH3)
Etil (CH3-CH2)
Hidrogén (H)
Hidroxil (OH)
Mivel csak egy királis szénatomja van, a bután-2-olnak:
Aktív izomerek:
IOA = 21
IOA = 2
Inaktív izomerek:
IOI = 21
2
IOI = 2
2
IOI = 1
Általam. Diogo Lopes Dias
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
NAPOK, Diogo Lopes. "Mi az izomerizmus?"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Hozzáférés: 2021. június 27.