Atom az anyag alakítójának nevezik (minden, ami helyet foglal és tömeggel bír). Ezt a nevet Democritus és Leucippus görög filozófusok javasolták. Kémiai elemek, molekulák, anyagok és szerves vagy szervetlen anyagokat atomok képeznek.
Felépítésében az atomnak vannak részecskéi (protonok, neutronok és elektronok), amelyek nem az anyag legkisebb részei. Még mindig, a megjelenítés nem lehetséges. Az atomról ismert tudományosan bizonyított fizikai, kémiai és matematikai szempontokhoz kapcsolódik.
Az atomról szóló ismeretek fejlődése számos technológiát fejlesztett és fejlesztett.
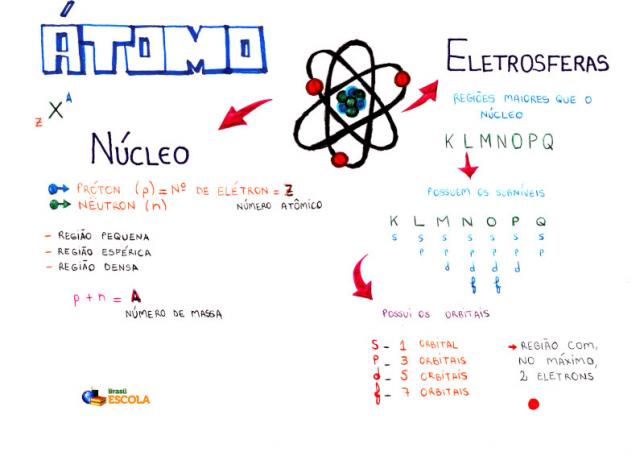
Az atom alapösszetétele
Mag: az atom sűrűbb régiója, és protonokat és neutronokat tartalmaz;
Energiaszintek: a magot körülvevő régiók, amelyek alszinteket, pályákat és elektronokat tartalmaznak. Hét energiaszint létezik, amelyeket K, L, M, N, O, P és Q betűk képviselnek;
Energiaszintek: olyan régiók, amelyek a pályákat helyezik el. Minden szinten jelen vannak, és betűkkel jelölik őket (s, p, d f). Mennyisége az egyes szintektől függ: K (van s alszintje), L (van s és p alszintje), M (van s, p és d alszintje), N (s, p, d és f alszintekkel rendelkezik), O (s, p, d és f alszintekkel rendelkezik), P (s, p és d alszintekkel rendelkezik) és Q (s és P);
Atompályák: régiók, amelyek nagy valószínűséggel találnak elektront. Mindegyik alszintnek különböző számú pályája van: s (egy pálya), p (három pálya), d (öt pálya) és f (hét pálya);
protonok: pozitív részecskék (p-vel ábrázolva);
elektronok: negatív részecskék, amelyek hullámviselkedéssel is rendelkeznek (e-vel ábrázolva);
neutronok: olyan töltés nélküli részecskék, amelyek csökkentik az atommagot a mag protonjai között (amelyet n jelöl).
Elmetérkép: Atom
* A gondolattérkép PDF formátumban történő letöltéséhez Kattints ide!
atom ábrázolása
Az atom képviseletének legegyszerűbb módja az általa képzett kémiai elem rövidítésének használata. A Se betűszó például a szelén kémiai elemet alkotó összes atomot jelenti.
Az atomot jelölő betűszó két fontos információval szolgálhat: az atomszám (amelyet Z betű képvisel és mindig a bal oldalon található az atom rövidítésének alja) és a tömegszám (A betűvel ábrázolva, amely a bal vagy a jobb oldalon elhelyezhető az atom rövidítésének tetején atom).
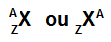
Tömegszámú és atomszámú atom rövidítése
atomszám (Z): jelzi az atom magjában lévő protonok számát és az energia szintekben jelenlévő elektronok (e) számát.
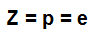
Képlet, amely az atomszám reprezentativitását jelzi
-
Tömegszám (A): jelzi az atom magjában jelenlévő tömeget, amely a protonok (p) és a neutronok (n) számának összegéből származik.
Ne álljon meg most... A reklám után még több van;)

Képlet, amely a tömegszám reprezentativitását jelzi
Atomi hasonlóságok
Ugyanazon kémiai elem vagy különböző kémiai elemek atomjai összehasonlíthatók a protonok, elektronok, neutronok és tömegük szempontjából, a következők szerint osztályozva:
a) Izotópok
Ezek olyan atomok, amelyek:
azonos atomszám;
ugyanannyi proton;
különböző tömegszám;
különböző számú neutron;
Példa:
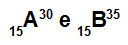
Az A és B atomok izotópok
Az A és B atomok izotópok, mert:
Az A atomnak 15 protonja van, atomszáma 15, 15 elektron, 15 neutron és tömegszáma 30.
A B atom 15 protonnal rendelkezik, atomszámuk egyenlő 15-vel, 15 elektron, 20 neutron, tömegszáma pedig 35.
b) Izobárok
Ezek olyan atomok, amelyek:
különböző atomszámok;
különböző számú proton;
különböző számú elektron;
azonos tömegszámok;
különböző számú neutron.
Példa:
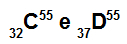
A C és D atom izobár
A C és D atom izobár, mert:
A C atomnak 32 protonja van, atomszáma 32, 32 elektron, 23 neutron és tömegszáma 55.
A D atomnak 37 protonja van, atomszáma 37, 37 elektron, 18 neutron és tömegszáma 55.
c) Izotónok
Ezek olyan atomok, amelyek:
különböző atomszámok;
különböző számú proton;
különböző számú elektron;
különböző tömegszámok;
ugyanannyi neutron.
Példa:
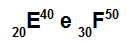
Az E és F atomok izotópok
Az E és F atomok izotópok, mert:
Az E atomnak 20 protonja van, atomszáma 20, 20 elektron, 20 neutron, tömegszáma pedig 40.
Az F atomnak 30 protonja van, atomszáma 30, 30 elektron, 20 neutron és tömegszáma 50.
d) Isoelektronika
Ezek olyan atomok, amelyek:
ugyanannyi elektron.
JEGYZET: az izoelektronikus atomoknak ugyanazt a tömegszámot (izobárok), ugyanannyi neutront (izotónt) vagy ugyanannyi protont (izotópot) lehet.
Példa:
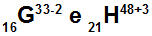
A G és H atomok izoelektronikusak
A G és H atomok izoelektronikusak, mert:
A G atomban 16 proton van, atomszáma 16, 18 elektron (a -2 jel azt jelzi, hogy kettővel több elektron van, mint a protonok száma), 17 neutron és tömegszáma 33.
A H atomban 21 proton van, atomszáma 21, 18 elektron (a +3 jel azt jelzi, hogy háromval kevesebb elektron van, mint a protonok száma), 27 neutron és tömegszáma 48.
Általam. Diogo Lopes Dias
Hivatkozna erre a szövegre egy iskolai vagy tudományos munkában? Néz:
NAPOK, Diogo Lopes. "Mi az atom?"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm. Hozzáférés: 2021. június 27.
Kémia
Az atomok és az Univerzum felépítése, az atomelmélet, hogy minden elkészül, az anyag atomokból áll, a négy elem elmélete, az ókori alkimisták, az atomelmélet, az alapvető részecske.
Kémia

Niels Bohr, Bohr atomja, atomfizika, stabil atom, atommodell, bolygórendszer, az elektroszféra rétegei, energiaszintek, elektronhéjak, elektronenergia, Rutherford atommodell, gerjesztett állapotú atom.

