Az atomszám, amelyet Z betű szimbolizál, megfelel az adott kémiai elem atomjának magjában lévő protonmennyiségnek. Például a hidrogén atomszáma 1, ami azt jelenti, hogy csak 1 proton van az atommagjában.
Az atomszám általában a kémiai elem alsó indexe mellett (az alsó sarokban) jelenik meg a bal oldalon. Példa: 1H.
Alapállapotban az atomszám megegyezik az elektronok számával, mivel ebben az állapotban az elem az semleges, ezért a pozitív töltések (protonok) mennyiségének meg kell egyeznie a negatív töltések (elektronok) mennyiségével atom.
Az atomszám azért fontos, mert ő határozza meg az elem fő jellemzőit és tulajdonságait, valamint viselkedését és elhelyezkedését a periódusos rendszerben. Az elemeket a periódusos rendszer az atomszám növekvő sorrendjében sorolja fel, amely általában az elem felett jelenik meg, az alábbiak szerint. Ne feledje, hogy az első elem hidrogén, H (Z = 1), majd hélium, He (Z = 2), majd jön a lítium, Li (Z = 3) és így tovább.
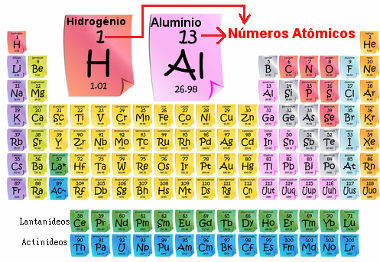
Elemek atomszáma a periódusos rendszerben
Egy kémiai elemet akár létként is elképzelhetünk „Azonos atomszámú atomkészlet”. Így amikor például az oxigén kémiai eleméről beszélünk, akkor a 8-as atomszámú atomokról beszélünk. Az alábbiakban megadjuk a periódusos rendszer 1. és 2. periódusának kémiai elemeinek atomszámát növekvő sorrendben:

A periódusos rendszer 1. és 2. periódusának kémiai elemei az atomszám növekvő sorrendjében
Az atomszámokat kezdetben Henry Gwyn Jeffreys Moseley angol fizikus (1887-1915) határozta meg, és amikor különböző elemek bombázásával járó kísérleteket hajtottak végre kémikusok röntgensugarakkal, megfigyelte, hogy az atommag emissziója által létrehozott röntgensugarak gyakoriságának négyzetgyöke egyenesen arányos a táblázat elemének atomszámával. Időszakos. Ezzel arra a következtetésre jutott, hogy az atomszám összefügg az atomok tulajdonságával, mert ez képviseli az egyes atomok pozitív töltéseinek számát.
A kémiai kötések nem befolyásolják az atomok atomszámát, mivel csak olyan elektronokat érintenek, amelyek az elektroszférában vannak. A nukleáris reakciók azonban magukban foglalják az atommagot, ezért az atomszám is szerepel.
Például, amikor részecskéket (főleg mérsékelt neutronokat) egy nehéz, instabil atommagra bombáznak, akkor az a mag megszakad, és két kisebb atommagot eredményez, vagyis kisebb számú protonnal és neutronnal, ami hatalmas mennyiségű energia.
A magfúzió viszont ellentétes folyamat, amikor két kicsi és könnyű mag egyesül, nagyobb és stabilabb magból származva még nagyobb mennyiségű energiát szabadít fel.
Tehát, amikor ezek a nukleáris reakciók bekövetkeznek, új kémiai elemek keletkeznek, mivel a kezdeti elemek atomszámai eltérnek a végső elemek atomszámától. Például lásd alább, hogy a 92-es atomszámú urán-235 hasadása báriumot (Z = 56), kriptont (Z = 36) és három neutront eredményez:

Az urán-235 maghasadási reakciója
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm

