Ebben az anyagban lépésről lépésre követi a különböző válaszok megalapozottságát és indoklásait gyakorlatok a kémiai egyensúlyról, amelyek a fizikai kémia ezen fontos ágának számos témáját felölelik.
1 - Az egyensúlyi állandó a koncentráció mol / l-ben kifejezve
Példa: (PUC-RS) A savas eső kialakulásában szerepet játszó egyensúlyt az alábbi egyenlet képviseli:
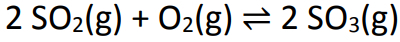
Egy literes edényben 6 mol kén-dioxidot és 5 mol oxigént összekevertünk. Egy idő után a rendszer egyensúlyba került, és a mért kén-trioxid-mol száma 4 volt. Az egyensúlyi állandó hozzávetőleges értéke:
a) 0,53
b) 0,66
c) 0,75
d) 1.33
e) 2.33
Helyes válasz: D betű
A gyakorlat az egyensúlyi állandó kiszámítását kéri a mol / L koncentrációban. Ennek a számításnak az elvégzéséhez egyensúlyi értékeket kell használnunk a reakció minden résztvevőjére. A Kc kifejezése a termékek koncentrációinak és a reagensek koncentrációinak szorzatával elosztott eredmény szorzata:
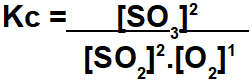
Nagyon körültekintően kell meghatároznunk az egyes résztvevők értékeit a mérlegben, mivel a gyakorlat nem mindig adja meg ezeket az adatokat, mint ez a példa. Tehát követnünk kell az alábbi lépéseket:
1. lépés: Állítson össze egy táblázatot ismert értékekkel.
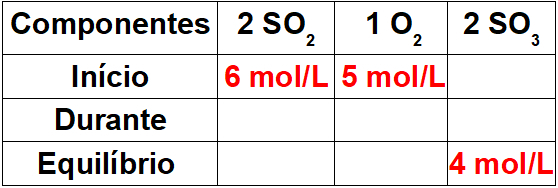
Mivel ez a reakció kezdete, a termék koncentrációja nulla lesz. Mivel a termékben az egyensúlyi érték mindig megegyezik a kezdet és az összeg összegével, a reakció során az érték 4 mol / l lesz.

2. lépés: Határozza meg az értékeket a reakció során.
A reakció során a reagensek értékének meghatározásához elegendő a termék ismert értékét a sztöchiometrikus arány alkalmazásával a reagensek értékéhez kapcsolni. 4 mol / l SO van3 a reakció során a mérleg 2. arányára. Mivel az OS aránya2 szintén 2, akkor 4mol / l lesz a folyamat során. az O-hoz2, csak 2 mol / L lesz, mert sztöchiometriai együtthatója 1.

A táblázat elkészítéséhez elegendő a kezdeti értéket levonni az időértékkel, hogy meghatározzuk a reaktánsok egyensúlyi értékeit.

3. lépés: Határozza meg a Kc értékét.
A Kc értékének meghatározásához egyszerűen használja az alábbi kifejezésben az egyensúlyban található értékeket:

2- Az egyensúlyi állandó a parciális nyomás szempontjából
Példa: (SANTOS-SP) Vegye figyelembe az alábbi egyensúlyi egyenletet:
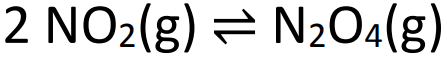
A fenti egyensúly elérésekor a nyomás 2 atm és 50% NO2 kötetben. Az egyensúlyi állandó értékének parciális nyomásokban (Kp) a következőknek kell lennie:
a) 0,2
b) 0,25
c) 1
d) 0,5
e) 0,75
Helyes válasz: C betű
A gyakorlat azt mutatja, hogy a teljes rendszernyomás egyensúlyi állapotban 2 atm és 50% (mólfrakció) NO2. Tehát először meg kell határoznunk az egyensúlyi állapotban lévő gázok parciális nyomását az össznyomás és a moláris frakció szorzatával:
hogy NEM2:
pNO2 = 0,5. 2
pNO2 = 1 atm
É-ra2O4: mivel csak két gáz van a rendszerben, az N százalékos aránya2O4 az is 50% lesz, hogy összesen 100% -ot eredményezzen.
pN2O4 = 0,5. 2
pN2O4 = 1 atm
Az egyensúlyi állandót a parciális nyomások szempontjából úgy számoljuk ki, hogy elosztjuk a a gáz halmazállapotú termékek résznyomásainak szorzata a reagens nyomások szorzatával gáznemű. Ebben az esetben a Kp kifejezése a következő lesz:

3- Egyensúly eltolódás
Példa: (PUCCAMP) A cseppkövek, kalcium-karbonát-lerakódások kialakulása a mészkőben gazdag régiókhoz közeli barlangokban a következő reverzibilis reakcióval ábrázolható:

Kérjük, tartsa be az alábbi feltételeket:
ÉN. Állandó vízpárolgás
II. Hideg és nedves légáram
III. A hőmérséklet emelkedése a barlang belsejében
IV. A hőmérséklet csökkentése a barlang belsejében
Az alábbiak közül melyik kedvez a cseppkövek kialakulásának?
a) I és II
b) I. és III
c) II. és III
d) II. és IV
e) III. és IV
Helyes válasz: B betű
A stalaktitok a kalcium-karbonát (CaCO3). A nyilatkozat megkérdőjelezi, hogy a feltüntetett feltételek közül melyik kedvez a cseppkövek kialakulásának. Ez tehát egy kb egyensúlyi eltolódás, mert a CaCO képződése3 akkor fordul elő, amikor az egyensúly elmozdul az Ön iránya felé (balra).
I- Igaz, mert amikor elpárolog, csökken a víz mennyisége (a mérlegtől balra található). Alapján Le Chatelier elve, amikor a résztvevő koncentrációja csökken, az egyensúly mindig az oldalukra tolódik.
II- Hamis, mivel a barlangok hideg és párás helyek, így a cseppkövek képződésének közvetlen reakciója exoterm. Ha hideg, nedves levegő áramlik, amely kedvez az exoterm folyamatnak és növeli a víz mennyiségét, belépve a barlangba, a reakció közvetlen irányba tolódik el, nem kedvez a cseppkövek.
III- Igaz, mivel a barlangok hideg és párás helyek, és a közvetlen reakció exoterm, ha a hőmérséklet a barlang növekedése, a reakció indirekt irányban (endoterm) elmozdul, ami elősegíti a cseppkövek.
IV- Hamis, mivel a barlangok hideg és párás helyek, és a közvetlen reakció exoterm, ha a hőmérséklet a barlang csökken, a reakció közvetlen irányba tolódik el (exoterm), ami nem kedvez a képződésének cseppkövek.
Lásd még:Kémiai egyensúly a barlangokban
4- Ionizációs állandó
Példa: (UECE) A koncentráció [H+] 6 × 10 oldatot-7 mol / liter sav H2S, Ki Ki-ionizációs állandóval 10-7, ugyanaz, mint:
a) 5 × 10-7 mol / liter
b) 6 × 10-7 mol / liter
c) 3 × 10-6 mol / liter
d) 2 × 10-7 mol / liter
Helyes válasz: D betű
Mivel csak egy savunk vagy egy bázisunk van, ez egy gyakorlat ionizációs állandó (Ki). Tehát az ilyen jellegű kérdések megoldásához ismerni kell az ionok és az elektrolit (sav vagy bázis) koncentrációját.
Az ionizációs állandón lévő gyakorlat megoldásának megkezdéséhez a savas ionizációs egyenletet kell használnunk (a gyakorlat esetében H2S) vagy az alap.
Ne álljon meg most... A reklám után még több van;)

Az összeállított egyenlet szerint a H koncentrációja+ azonos a HS-vel- a sztöchiometrikus arány miatt egyensúlyban van. Mivel nem ismerjük ezeket az értékeket, x-et fogunk használni mindkét koncentrációra.
Megjegyzés: x-et mindkét koncentrációhoz használhatunk, mert a termékkel van dolgunk.
1. lépés: A Ki kifejezés összerakása.
Az egyensúlyi ionizációs állandó expressziójának összeállítása az állandó ugyanazon elvét követi a mol / l koncentráció tekintetében.
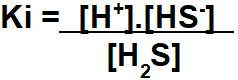
2. lépés: Használja a gyakorlat által megadott értékeket az összeállított Ki kifejezésben.

3. lépés: Számítsa ki a delta értéket.

4. lépés: Számítsa ki a talált delta lehetséges x értékét.

X1 esetén
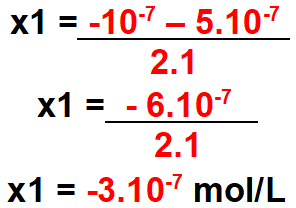
Megjegyzés: a koncentráció nem lehet negatív. Tehát ez az érték nem érvényes.
X2 esetén

5- Ostwald hígítási törvénye
Példa: (ITA) Egy monokarbonsav 0,100 mol / l vizes oldatában 25 ° C-on a sav 3,7% -ban disszociál az egyensúly elérése után. Ellenőrizze az opciót, amely a sav disszociációs állandójának megfelelő értékét tartalmazza ezen a hőmérsékleten.
a) 1.4
b) 1,4 × 10-3
c) 1,4 × 10-4
d) 3,7 × 10-2
e) 3,7 × 10-4
Helyes válasz: C betű
Keresztül Ostwald hígítási törvénye, egy erős elektrolit (α nagyobb, mint 5%) ionizációs állandóját (Ki) a következő képlettel számoljuk ki:

A gyenge elektrolit (α értéke kevesebb, mint 5%) ionizációs állandójának kiszámításához a következő képletet használjuk:
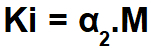
Az Ostwald-féle hígítási törvény gyakorlata könnyen felismerhető, mivel mol / L (jelen esetben 0,100 mol / L) koncentrációt mutat be. egyetlen elektrolit (monokarbonsav), disszociációs százalék (α = 3,7%) vagy disszociációs vagy ionizációs állandó (Ki).
Mivel a sav gyenge, így:

6- pH-értéket és pOH-t tartalmazó kémiai egyensúly
Példa: (PUC-MG) Három tartályban X, Y és Z ismeretlen bázikus oldatot tartalmaz 0,1 mol / l koncentrációban. A három oldat pH-jának univerzális indikátorpapírral történő mérésével a következő értékeket kaptuk: pH = 8, pH = 10 és pH = 13. Jelölje be a HELYES utasítást:
a) Az OH koncentrációja- a Z bázis értéke 10-13 mol / L.
b) Kb az X bázisból nagyobb, mint Kb az Y bázisból.
c) Az Y bázis jobban vezeti az elektromos áramot, mint a Z bázis.
d) Az X bázis teljesen ionizált.
e) A Z palackban erős alap van.
Helyes válasz: E betű
A gyakorlat megoldásának megkezdéséhez emlékeznie kell néhány fontos szempontra:
Első: pH + pOH = 14
Második: minél magasabb a pH, a 7-es értékhez viszonyítva, annál bázikusabb az oldat. Minél lúgosabb az oldat, annál nagyobb a hidroxid-anionok koncentrációja [OH-].
Harmadik: [OH-] = 10-OH
Szoba: minél kisebb a pOH, annál nagyobb a Kb, vagyis annál ionizáltabb vagy disszociáltabb lesz a bázis.
Tehát ezen ismeretek alapján kövesse az alábbi lépéseket lépésről lépésre a probléma megoldásához:
1. lépés: Határozzuk meg az egyes oldatok pOH-ját.
X megoldás esetén:
pH + pOH = 14
8 + pOH = 14
pOH = 14-8
pOH = 6
Y megoldáshoz:
pH + pOH = 14
10+ pOH = 14
pOH = 14-10
pOH = 4
A Z megoldáshoz:
pH + pOH = 14
13 + pOH = 14
pOH = 14-13
pOH = 1
2. lépés: Az A alternatíva megítéléséhez meg kell határoznunk a Z oldat hidroxid-koncentrációját.
[ó-] = 10-OH
[ó-] = 10-1 mol / l,
Hamarosan a az A alternatíva hamis.
3. lépés: Hasonlítsa össze az X Kb alapot az Y alappal.
Az X Kb bázis kisebb, mint az Y Kb bázis, mert pOH-ja nagyobb. Hamarosan a a B alternatíva hamis.
4. lépés: Társítsa a pOH-t az erővel és a disszociációval.
Az elektromos áram vezetése a legjobban olyan oldatokban fordul elő, amelyekben erős elektrolit van, magasabb pOH-val. Az Y bázis nem vezeti jobban az elektromos áramot, mint a Z bázis, mert a pOH-ja alacsonyabb, így kevesebb ion szabadul fel. Így a a C alternatíva hamis.
5. lépés: Kapcsoljuk össze a pOH-t disszociációval.
Minél kisebb a pOH, annál jobban disszociál a bázis. Mivel a legnagyobb pOH-val rendelkező oldat az X tartályban van, a legkevesebb disszociált oldatot tartalmazza. Ezért a a D alternatíva hamis.
Lásd még: A száj és a fogszuvasodás pH-ja
7- Pufferoldat
Példa: (UFES) Az emberi vér pH-ját különböző puffer rendszerek szűk tartományban (7,35 - 7,45) tartják. Mutassa be az egyetlen alternatívát, amely a puffer rendszerek egyikét képviselheti:
a) CH3COOH / NaCl
b) HCl / NaCl
c) H3POR4 / NaNO3
d) KOH / KCl
e) H2CO3 / NaHCO3
A válasz erre a kérdésre az E alternatíva, mert ez egy pufferelési megoldás vagy puffer rendszer. Ez az oldat két oldat: egy sav (a gyakorlatban a H2CO3) vagy gyenge bázis és ugyanaz a savkomponensű só (edzés közben NaHCO3) vagy az alap.
a- Hamis, mert ez egy gyenge sav és egy olyan só keveréke, amelynek nincs savas komponense.
b- Hamis, mert ez egy erős sav által alkotott keverék, mivel a HCl egyike a három erős savnak (a többi HBr és HI).
c- Hamis, mert ez egy mérsékelt sav és egy olyan só keveréke, amely nem tartalmaz savas komponenst.
d- Hamis, mert ez egy erős bázis által alkotott keverék (alkálifém-család eleme van).
Lásd még: Pufferoldat emberi vérben
Általam. Diogo Lopes Dias



