Friedrich Kohlrausch (1840-1910) tudós elsőként javasolta, hogy a tiszta víz vezesse az áramot, bár kis mértékben. A víz ugyanis amfoter módon viselkedik; vagyis bizonyos esetekben savként viselkedik, protonokat adományoz (H+); másokban pedig bázisként viselkedik, protonokat kap.
Ez azt jelenti, hogy a víz elvégzi a saját ionizációját az alább látható kémiai egyenlet szerint:
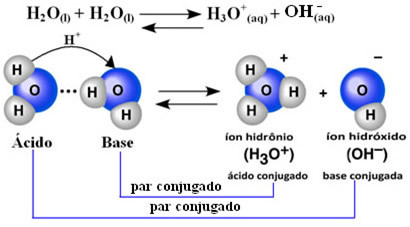
Ezt a folyamatot hívják víz autoionizáció és nagyon kis léptékben fordul elő, vagyis a víz nagyon gyenge elektrolit, alacsony az ionizációs fok és az egyensúlyi egyensúlyi értékek (Kç). Pontosan ezért van ilyen alacsony vezetőképessége a víznek.
Elképzeléshez 25 ° C-os környezeti hőmérsékleten meg lehet állapítani, hogy a tiszta víz önionizálásakor keletkező hidroxid- és hidronium-ionok koncentrációja egyenlő-e 1-vel. 10-7 mol. L-1. Ez azt jelenti, hogy egymilliárd vízmolekulából csak kettő ionizál.
A víz ion egyensúlyi állandóját nevezzük ça víz disszociációs állandója,autoprotolízis állandóvagy a víz ionterméke.Ezt az állandót a Kw, mert a w a szóra utal víz, ami angolul vizet jelent.
Ne álljon meg most... A reklám után még több van;)
Számítását ugyanúgy végezzük, mint a többi egyensúlyi állandót, emlékezve erre, amint azt a " Kc és Kp egyensúly ”, ebben az esetben csak a termékek jelennek meg a kifejezésben, mert a folyékony állapotú víznek ugyanaz az aktivitása 1-ig. A tiszta folyékony vagy szilárd anyagok nem kerülnek a disszociációs állandó kifejezésbe, mert nem változnak. Csak vizes és gáznemű oldatokat helyeznek el. Tehát:
Kw = [H3O+]. [ó-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Mint a többi egyensúlyi állandónál, rendbenw csak a hőmérséklet változásával változik. A víz hőmérsékletének növekedésével az ionizációja is növekszik, ami azt jelenti, hogy a víz önionizálása endoterm folyamat, vagyis elnyeli a hőt.
Ez látható a víz iontermékének értékeiben (Kw) az alábbi táblázatban, különböző hőmérsékleteken:
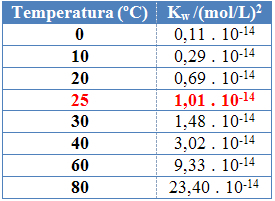
A víz iontermékének mindig fix értéke lesz minden hőmérsékleten, akár tiszta vízben, akár oldatban. Még akkor is, ha az oldat H-koncentrációjú3O+ és ó- eltérő, a köztük lévő termék állandó marad.
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Ionikus víztermék (Kw)"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Hozzáférés: 2021. június 28.


