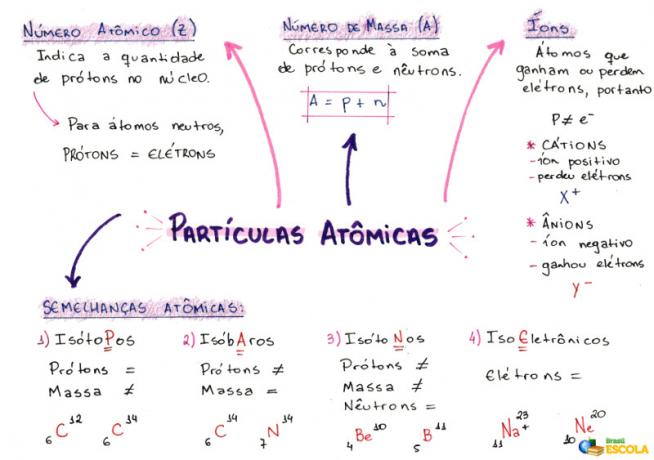
O az atomrészecskék számának kiszámítása a protonok (a magban), az elektronok (az elektroszférában) és a neutronok (a magban) mennyiségének jelzésére szolgál bármely atomban vagy ionban. Ehhez elengedhetetlen az atomok néhány jellemzőjének ismerete:
1- Atomszám (Z)
Ez egy matematikai kód, amelyet nagy Z betű képvisel, és amely az atom rövidítésének bal alsó részén helyezkedik el:
Zx
Jelzi a protonok számát (p) a magban és az elektronok számát (e) egy atom elektroszférájában. Tehát általánosságban:
Z = p = e
2- Tömegszám (A)
Ez egy matematikai kód, amely megegyezik a protonok (p) és a neutronok (n) számának összegével, mindkettő bármely atomban jelen van. A tömegszámot ábrázoló egyenletet az alábbiak adják meg:
A = p + n
Mivel a protonok száma megegyezik az atomszámmal, a következőképpen írhatjuk fel az egyenletet a tömegszám kiszámításához:
A = Z + n
Ha ismerjük az atom tömegszámát és atomszámát, a következőképpen határozhatjuk meg a neutronok számát:
n = A - Z
3- ionok
Ezek olyan atomok, amelyek elveszítik vagy megszerzik az elektronokat. Pozitív vagy negatív előjellel rendelkeznek az ábrázolásuk jobb felső sarkában, a következő modell szerint:
x+ vagy X-
Pozitív ion: Ezt kationnak nevezzük, és a pozitív jel azt jelzi, hogy elvesztette az elektronokat.
Negatív ion: Ezt nevezzük anionnak, és a negatív jel azt jelzi, hogy elektronokat nyert.
Ne álljon meg most... A reklám után még több van;)
4- Atomi hasonlóságok
a) Izotópok
Azok az atomok, amelyek azonos atomszámmal és különböző tömegszámmal rendelkeznek. Példa:
7x14 és 7Y16
Az X és Y atomok azonos atomszámmal rendelkeznek (a rövidítés bal oldalán), azaz egyenlőek 7-vel. Az X atom tömegszáma (a rövidítés jobb oldalán) 14, az Y atomé pedig 16.
b) Izobárok
Azok az atomok, amelyeknek ugyanaz a tömegszáma és különböző atomszáma. Példa:
15x31 és 13Y31
Az X és Y atomok tömegszáma (a betűszótól jobbra) 31. Az X atom atomszáma viszont 15, az Y atomé pedig 13.
c) Izotónok
Azok az atomok, amelyeknek különböző tömegszáma és atomszáma van, de ugyanannyi neutronja van.
d) Isoelektronika
Azok az atomok, amelyeknek azonos számú elektronja van. Példa:
12x+2 és 7Y-3
Az X atom atomszáma egyenlő 12-vel, és kation (pozitív töltés +2), tehát két elektronot veszít, így 10 elektron van az elektroszférájában. Az Y atom atomszáma viszont egyenlő 7-vel és anion (negatív töltéssel -3), tehát három elektronra tesz szert, így 10 elektron van az elektroszférájában.
Elmetérkép: Atomrészecskék
* A gondolattérkép PDF formátumban történő letöltéséhez Kattints ide!
Példák az atomrészecskék számának kiszámítására
1. példa: Határozza meg az atomban lévő protonok, neutronok és elektronok számát 14x29.
Az X atomra a következő értékeket adtuk meg:
Tömegszám (jobb felső sarokban) = 29
Atomszám (balra lent) = 14
A protonok számának meghatározása:
A protonok száma mindig megegyezik az atomszámmal, tehát az X atomnak 14 protonja van.
Az elektronok számának meghatározása:
Mivel az X atom nem ion, ezért az elektronok száma megegyezik a protonok számával, vagyis 14-vel.
A neutronok számának meghatározása:
A neutronok számát a tömeg és a protonok számával határozzuk meg a következő képlettel:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
2. példa: Határozza meg az X ion protonjainak, neutronjainak és elektronjainak számát+3, tudva, hogy tömegszámuk és atomszámuk 51, illetve 23.
A következő értékeket adtuk az X ionra:
Tömegszám = 51
Atomszám (balra lent) = 23
A protonok számának meghatározása:
A protonok száma mindig megegyezik az atomszámmal, tehát az X atom 23 protonnal rendelkezik.
Az elektronok számának meghatározása:
Az X ion pozitív (+3), tehát három elektron elvesztését végző kationról van szó. Tehát az elektronok száma 20.
JEGYZET: Az elektronok számának csökkenése vagy növekedése mindig az atomszámhoz viszonyítva következik be.
A neutronok számának meghatározása:
A neutronok számát a tömeg és a protonok számával határozzuk meg a következő képlettel:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
3. példa: A W atom atomszáma és tömege megegyezik 29-gyel és 57-gyel, mivel aa izomerje Y atom, amelynek atomszáma 30, amely egy B atom izotópja, amelynek tömegszáma 65. Ezzel az információval határozza meg a B atomban lévő protonok, neutronok és elektronok számát.
A gyakorlat által szolgáltatott adatok:
Atom W
atomszám (bal alsó rész) = 29
tömegszám (jobb felső sarokban) = 57
Y izobár, azaz Y tömege szintén 57.
Y atom
atomszám = 30
tömegszám = 57
Ezzel a két értékkel meg kell határoznunk a neutronszámát, mert ez a B elem izotónja:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
B atom:
tömegszám = 65
a neutronok száma = 27
Ezekkel az adatokkal meg kell határoznunk az atomszámát, mert ezzel meg fogjuk határozni a protonok számát és az elektronok számát (mivel ez nem ion):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Ezért a B atomnak 38 protonja, 38 elektronja és 27 neutronja van.
* Elmetérkép, Victor Ricardo Ferreira
Kémia tanár
Általam. Diogo Lopes Dias