Az ionok közötti kötés az ionok között fordul elő, amint a neve is mutatja. Mivel ellentétes töltésűek, a kationok (pozitív töltésű elem) és az anionok (negatív töltésű elemek) elektrosztatikusan vonzzák egymást, kialakítva a kötést. Az ionos szilárd anyagot azonban a kationok és anionok agglomerátuma alkotja, jól meghatározott geometriai alakzatokkal, úgynevezett rácsokkal vagy kristályos rácsokkal.
Például a só (nátrium-klorid) egy elektron végleges átvitelével képződik nátriumról klórra, ami nátrium-kationt eredményez (Na+) és a klorid-anion (Cl-). A gyakorlatban ez a reakció nemcsak két atomot foglal magában, hanem hatalmas és határozatlan számú atomot alkot, amelyek köb alakú kristályrácsot képeznek, amint az alábbiakban látható:
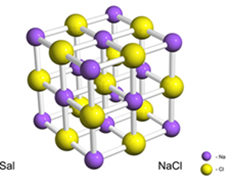
Ha pásztázó elektronmikroszkóppal nézzük a sókristályokat, látni fogjuk, hogy valójában belső felépítésük miatt kocka alakúak.

Mivel minden ionos vegyület meghatározatlan és nagyon sok ionból áll, hogyan képviselhetünk ionos vegyületet?
Az általában használt képlet a
egység képlet, amelyik az a kristályrácsot alkotó kationok és anionok lehető legkisebb számával kifejezett arányt jelenti, így a vegyület teljes töltete semlegesített. Ehhez szükséges, hogy az atom által leadott elektronok száma megegyezzen a másik atom által befogadott elektronok számával.Néhány szempont az ionos vegyületek egységképletével kapcsolatban fontos, lásd néhányat:
Ne álljon meg most... A reklám után még több van;)
- Először mindig írja be a kationt, majd az aniont;
- Mivel minden ionvegyület elektromosan semleges, az egyes iontölteteket nem kell leírni;
- Az egyes ionok jobb oldalán megjelenő indexszámok a kation atomjainak az anionhoz viszonyított arányát jelzik. Ezeket a számokat indexeknek nevezzük, és az 1 számot nem írjuk.
Például nátrium-klorid esetében az egység képlete NaCl, mivel minden klorid-anionhoz pontosan 1 nátrium-kation tartozik.
Lásd még egy példát, Al3+ három pozitív töltése van, míg az F- csak egy negatívuma van, ezért a vegyület semlegesítéséhez három fluoridanionra van szükség. Így arra a következtetésre jutunk, hogy egységképlete AlF3.
Az ionvegyület egységképletének elérésének egyszerű módja az, ha a töltéseit indexekre cseréljük, amint az alábbiakban általános módon bemutatjuk:
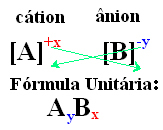
Példák:

Az ionos anyagok képviseletére használt másik képlet a Lewis-formula vagy elektronikus képlet, mit az elem szimbólum körüli "golyó" ionok vegyértékes héjából származó elektronokat képviseli. A só esetében:

Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Az ionos kötések ábrázolásának képletei"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm. Hozzáférés: 2021. június 28.
b) Határozza meg az x értékét a nátrium-alumínium-fluorid képletében!
Ionvegyületek, az ionvegyületek főbb jellemzői, az ionok közötti kötés, az elektronok végleges átadása, elektrosztatikus vonzerők az ionok között, negatív és pozitív ionok, anionok, kationok, ionkötések, molekuláris szerkezet ő
Carbon térképlete, Lewis elektronikus képlete, síkszerkezete, elektronikus párok, kötés kovalens, vegyértékréteg, az atommodell evolúciója, molekulaképlet, szerkezeti képlet, képletek háromdimenziós.
Kémiai képletek, lapos szerkezeti képlet, Couper szerkezeti képlet, hármas kötés, gáz nitrogén, elektronikus képlet, Lewis-formula, molekulaképlet, egyszeres kötés, kettős kötés, gáz szénsavas.
Kémia

Ionkötés, ionos vegyületek, ionos agglomerátumok, nátrium-klorid, konyhasó, ionos anyagok, elektrosztatikus vonzerők, klorid-anionok, nátrium-kationok, poláros oldószerek, pozitív ionok, kationok, negatív ionok, anionok.