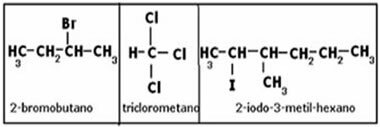
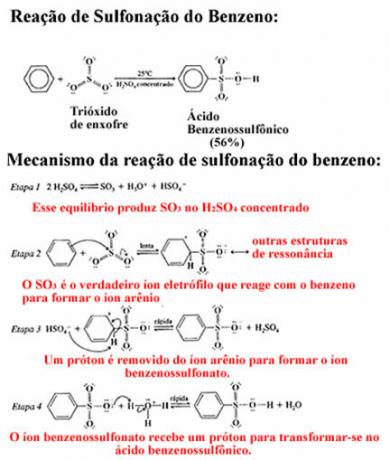
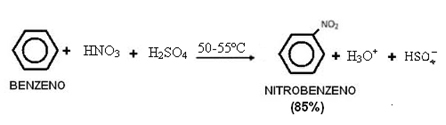
Polarnost molekula vrlo je važan aspekt, budući da su svojstva tvari, između ostalih čimbenika, određena činjenicom da su njihove molekule polarne ili nepolarne.
Određivanje polarnosti molekule može se izvesti pomoću Dipolni trenutak ili Rezultat dipolnog trenutka, čiji je simbol 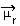 . Ako govorimo samo o dipolnom trenutku svake veze u molekuli, tada je simbol grčko slovo mi (µ).
. Ako govorimo samo o dipolnom trenutku svake veze u molekuli, tada je simbol grčko slovo mi (µ).

Molekula će biti nepolarna ako je dipolni trenutak jednak nuli, ali ako je nula, znači da je polarna.

Dvije su važne stvari koje treba uzeti u obzir pri određivanju ovog rezultirajućeg dipolnog trenutka. Da vidimo što su:
1) razlika elektronegativnosti između atoma elemenata koji sudjeluju u reakciji. Na primjer, molekula HF ima značajnu razliku u elektronegativnosti, jer fluor privlači, mnogo više od vodika, par elektrona u vezi. Dakle, raspodjela naboja nije simetrična, s električnim dipolima.
Taj je dipol predstavljen vektorom koji je okrenut prema kraju koji koncentrira najviše elektrona, odnosno od najmanjeg do najolektronegativnijeg atoma. Dakle, u ovom će slučaju vektor, koji je jedini, biti rezultirajući vektor, kao što je naznačeno u nastavku:
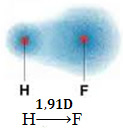
Imajte na umu da je vektorska vrijednost jednaka dipolnom trenutku, koji je dan u debye jedinici (D = 3,33. 10-30 coulomb. podzemna željeznica). Budući da dipolni moment nije nula, molekula i veza jesu polarni.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
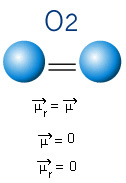
U molekuli dolje imamo i molekulu sa samo dva atoma, međutim, u ovom slučaju ona odgovara jednostavnoj tvari, odnosno sastoji se od samo jedne vrste elemenata. Stoga nema razlike u elektronegativnosti; atomi također privlače elektrone koji su simetrično raspoređeni. Rezultirajući dipolni moment jednak je nuli, pa su i veza i molekula apolar.
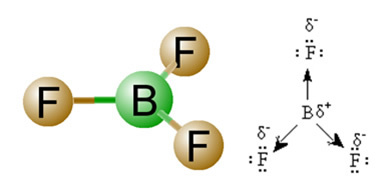
2) Geometrija molekula, odnosno prostorni raspored vektora. Molekula BF3 ima tri polarne veze, u kojima je fluor najelektronegativniji, tako da su vektori usmjereni prema njemu. Međutim, budući da je prostorni raspored atoma ravni trigonalni, to elektrone ima simetričnu raspodjelu oko središnjeg atoma. Dakle, rezultat je da se ova tri vektora međusobno poništavaju, a dipolni trenutak jednak je nuli. Prema tome, molekula BF3 é apolat.
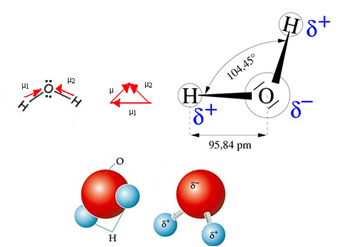
Molekula vode ima dva vektora, međutim, njena prostorna geometrija nije ravna, već je u obliku V. Na slijedećoj slici imajte na umu da se na taj način njihovi vektori međusobno ne isključuju, elektroni se distribuiraju asimetrično i koncentriraniji u najelektronegativnijem atomu, a to je kisik. Dakle, dipolni moment se razlikuje od nule, a molekula vode je polarni:
Napisala Jennifer Fogaça
Diplomirao kemiju