Kiseline su tvari koje ioniziraju se u vodenom mediju i dobri su dirigenti vlast. Kiselost tvari može se izmjeriti tehnikama za mjerenje ionskog potencijala vodika (pH) rješenja. Neke pH analitičke metode koriste indikatore poput lakmusa ili fenolftaleina, koji odražavaju pH vrijednost otopine u boji.
Kiseline se mogu karakterizirati:
prisutnošću kisika u njegovoj molekuli ili ne;
na silu;
pomoću ionizirajućih vodika;
svojom volatilnošću.
Pročitajte i vi:Usporedba kiselina i baza - razlike i svojstva
Karakteristike kiselina
Oni se joniziraju u vodenom mediju, oslobađajući H kation+.
Oni su provodnici električne energije zbog oslobađanja ioni u vodenom mediju.
U kontaktu s osnovnom okolinom pate reakcija neutralizacije, stvarajući sol i vodu kao produkte ove reakcije.
Oni mijenjaju boju otopine u prisutnosti indikatorske tvari poput lakmusa ili fenolftaleina.
Kiseli okus limuna, naranče, među ostalim agrumima, zaslužan je za kiselinu prisutnu u tim namirnicama.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Vodikov potencijal (pH)
Potencijal vodikovih iona (pH) izračun je koji izražava koncentracija iona od vodik u izvjesnom riješenje. Za određivanje pH i analizu medija uzima se u obzir sljedeće:
Ostwaldov zakon razrjeđenja (što je više razrijeđeno, više će iona nastati u otopini);
autoionizacija vode (Kw), što je prirodni raspad molekule H2O u H ionima+ i oh-;
destilirana voda na 25 ° C ima autoionizaciju Kw = 10-14 i jednaka koncentracija H iona+ i oh-, odnosno neutralan je medij.
Za proračun pH koji uključuje koncentraciju H+, koristiti: pH = -log [H+].
Znam da:
pH> 7 → osnovna otopina
pH <7 → kisela otopina
pH = 7 ili pH = pOH → neutralna otopina
Pogledajte i: Kakve su formule kiselina?

Klasifikacija kiselina
THE klasifikacija kiselina može se obaviti uzimajući u obzir četiri različita kriterija.
Stupanj ionizacije (α) ili jačine kiseline
α = broj ioniziranih molekula
broj otopljenih molekula
Jake kiseline: α ≥ 50%.
Primjer: ákiselina sumporna (H2SAMO4) → α = 61%.Polujake ili umjerene kiseline: 5% < α < 50%.
Primjer: fosforna kiselina (H3PRAH4) → α = 27%.Slabe kiseline: α ≤ 5%.
Primjer: borna kiselina (H3BO3) → α = 0,075%.
→ Broj ioniziranog vodika
monokiselina: oslobađa H kation+.
Primjer: ákiselina klorovodična (HCL);
dijacidna kiselina: oslobađa dva H kationa+.
Primjer: sumporovodik (H2S).Triacid: oslobađa tri H kationa+.
Primjer: borna kiselina (H3BO3).tetracidna: oslobađa četiri H kationa+.
Primjer: pirofosforna kiselina (H4Str2O7).
Pažnja! U slučaju hidracida, svi vodikovi u molekuli mogu se ionizirati; ali u slučaju oksijakiselina, ioniziraju se samo vodikovi koji su povezani s atomom kisika. Primjer je hipofosforna kiselina (H3PRAH2), što je monokiselina jer, unatoč tome što u svom sastavu ima tri vodika, oslobađa samo vodik koji je vezan za kisik.
→ Prisutnost kisika
oksiakiseline: imaju kisik u svojoj strukturi.
Primjer: hipoklorna kiselina (HO Cl).
Hidracidi: nemaju kisik u svojoj strukturi.
Primjer: fluorovodična kiselina (HF).
→ Hlapljivost
Fiksno: vrelište(NOGA) > 100 ° C, polako prelazeći u plinovito stanje.
Primjer: sumporna kiselina (H2SAMO4) → PE = 340 ° C.hlapljive materije: vrelište <100 ° C, brzo i lako prelazi u plinovito stanje.
Primjer: sumporovodik (H2S) → PE = -59,6 ° C.
Nomenklatura kiselina
→ Hidracidi
Kiselina + naziv aniona + hidrid
Za sve kiseline pojam "kiselina" koristi se prije nomenklature koja karakterizira molekulu. U hidracidima sufiks "eto" imena elementa zamjenjuje se s "hidrični".
Primjeri:
HCl → kiselina klorhidrični
HBr → kiselina bromhidrični
VF → kiselina fluorhidrični
→ oksiakiseline
Nomenklatura oksiokiselina varira ovisno o oksidacijski broj (NOX) središnjeg elementa. Pogledajte donju tablicu:
NOX središnjeg elementa |
Nomenklatura kiselina |
||
prefiks- |
-infix- |
-sufiks |
|
+1 i +2 |
Konj- |
-anion-ime- |
-oso |
+3 i +4 |
-- |
Ime aniona- |
-oso |
+5 i +6 |
-- |
Ime aniona- |
-ic |
+7 |
Po |
-anion-ime- |
-ic |
Primjeri:
HClO → Znajući da vodik (H) obično ima NOX +1, a kisik (O) NOX -2, da bismo imali molekulu s 0 punjenja, klor (Cl) mora imati NOX +1, pa je nomenklatura ove kiseline hipoklorna kiselina.
HNO2 → dušična kiselina
HClO4 →ákiselinaperklorna
→ Iznimke od pravila
H2CO3 → ugljična kiselina, a ne ugljični, kao što bi to bilo pod pravilom NOX.
H3BO3 → ákiselina boric, a ne drsko.
Kiseline u svakodnevnom životu
Gnojiva i lijekovi: Fosforna kiselina (H3PRAH4) se široko koristi u proizvodnji gnojiva i također kao lijek. Jedna je od nekoliko kiselina koje se koriste u farmaceutskom polju.
Agrumi: imaju askorbinsku kiselinu (C6H8O6), također poznat kao Vitamin C.
Ocat: ima u svom sastavu Octena kiselina (CH3COOH).
- Pjenušava voda i bezalkoholna pića: sastavljen od ugljične kiseline (H2CO3), što proizvodu daje osvježavajući osjećaj.
Također pristupite:Uloga kiselina u bezalkoholnim pićima

riješene vježbe
Pitanje 1 - (Enem) Sok ekstrahiran iz crvenog kupusa može se koristiti kao pokazatelj kiselog karaktera (pH između 0 i 7) ili osnovnog (pH između 7 i 14) različitih otopina. Miješanjem malo soka od kupusa i otopine, smjesa počinje pokazivati različite boje, u skladu s kiselinskom ili baznom prirodom, prema donjoj ljestvici.
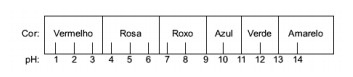
Neka su rješenja testirana s ovim pokazateljem, dajući sljedeće rezultate:
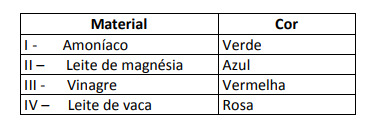
Prema tim rezultatima, rješenja I, II, III i IV imaju sljedeći karakter:
A) kiseli / bazični / bazični / kiseli.
B) kiselina / bazna / kiselina / bazna.
C) bazični / kiseli / bazni / kiseli.
D) kiselina / kiselina / bazna / bazna.
E) Osnovna / Bazna / Kiselina / Kiselina.
Razlučivost
Alternativa E. Da bi se utvrdilo ima li tvar kiseli, bazični ili čak neutralni karakter, provodi se analiza boja dobivenih u testu u odnosu na podatke dane skale. Znajući da su otopine s pH = 7 neutralne, pH> 7 bazične i s pH <7 kisele, dolazimo do zaključak da su amonijak i magnezijevo mlijeko osnovne tvari, a ocat i kravlje mlijeko kiseline.
Pitanje 2 - (PUC-Camp) Što se tvari naziva kiselinama, student je primijetio sljedeće karakteristike:
Ja - imam korozivnu snagu;
II - sposobni su neutralizirati baze;
III - sastoje se od dva kemijska elementa;
IV - oblikuju vodene otopine koje provode električnu struju.
Pogriješio je SAMO u
A) I i II
B) I i III
C) I i IV
D) II i III
E) III i IV
Razlučivost
Alternativa B. Nisu sve kiseline korozivne, samo one najjače, a kiseline mogu biti sastavljene od dva ili više atoma.
Laysa Bernardes
Učitelj kemije
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
ARAúJO, Laysa Bernardes Marques de. "Kiseline"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/acidos.htm. Pristupljeno 27. lipnja 2021.