Hidrogeniranje se događa s nezasićenim acikličkim ugljikovodicima, odnosno koji imaju otvorene lance s dvostrukim ili trostrukim vezama, kao što su alkeni, alkini i dieni. Može se pojaviti i u aromatičnim ugljikovodicima, jer imaju dvostruke veze u prstenu, te s ciklanima (cikloalkanima) do pet ugljika.
Ti spojevi reagiraju poput plina vodika u prisutnosti nekog katalizatora, poput nikla, platine i paladija, zagrijavanjem. Dakle, dolazi do reakcije adicije, u kojoj se pi (π) veza prekida stvarajući dvije nove jednostruke veze i vodik se uvodi u molekulu.
Općenito imamo:
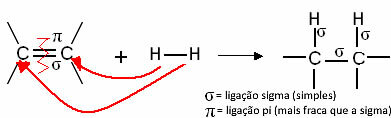
Generička reakcija hidrogeniranja
Pogledajmo sada nekoliko primjera:
- Hidrogeniranje u alkene: Dobiveni proizvod je alkan.
Ispod imamo reakciju hidrogeniranja etilena (ili etilena) za dobivanje etana:
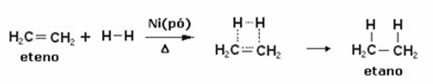
Primjer reakcije hidrogeniranja etilena
Ovu vrstu katalitičkog hidrogeniranja prehrambena industrija koristi za stvaranje polukrutih masti kao što su margarini. Biljna ulja i masti razlikuju se samo po tome što ulja imaju duge molekule s dvostrukim vezama između ugljika, dok masti imaju samo jednostruke veze između svojih ugljika.
Dakle, da bi se ulje pretvorilo u mast, dovoljno je hidrogenirati ulje. Na taj će se način vaše dvostruke veze razbiti i pretvoriti u jednostruke. Rezultat je proizvodnja poziva hidrogenirane biljne masti.
- Hidrogeniranje alkina: Budući da alkini imaju dvije pi veze, njihovo se potpuno hidrogeniranje odvija u dva stupnja, u prvom se stvara alken, a u drugom alkan.
U donjoj reakciji imamo hidrogeniranje propina s konačnim stvaranjem propana:
1. korak: H3C C ≡ CH + H2 → H3C CH═ ÇH2
2. faza: H3C CH═ ÇH2 + 2 sata2 → H3C CH2─ ÇH3
Ako želimo da se ova reakcija zaustavi u prvom koraku, moramo upotrijebiti neku tvar koja zaustavlja djelovanje katalizatora.
- Hidrogeniranje diena: Postoje tri vrste diena: nagomilano (dvostruke veze pojavljuju se u nastavku), izolirani (dvostruke veze su odvojene s najmanje dvije jednostruke veze) i konjugati (dvostruke veze se pojavljuju naizmjenično).
Hidrogeniranje nakupljenih i izoliranih diena događa se na isti način kao što smo vidjeli kod alkena, ali u dvostrukom, jer dieni imaju više nezasićenja. Pogledajte dva primjera:
* Primjer hidrogeniranja u akumuliranom dienu:
H H H
│ │ │
H3C CH ═ Ç ═ CH ─ CH3 + 2 sata2 → H3C CH ─ Ç ─ CH ─ CH3
│ │ │
H H H
* Primjer hidrogeniranja u izoliranom dienu:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 ─ CH ═ CH ─ CH3 +2 H2 → H3C CH ─ CH─CH2 ─ CH ─ CH ─ CH3
S druge strane, hidrogeniranje konjugiranih diena može se dogoditi na dva načina: dodavanjem 1,2 i 1,4 dodavanja. Najčešći je dodatak 1,2, u kojem se vodik dodaje ugljiku koji stvara dvostruku vezu i na niskim temperaturama. Dodatak 1,4, s druge strane, događa se na povišenim temperaturama i to kada postoji rezonancija i pojava slobodnih valencija u ugljiku 1 i 4. Pogledajte primjere svakog slučaja:
* Primjer dodavanja 1.2 u konjugiranim dijenima:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH CH2
│ │
H H
* Primjer dodatka 1.4 u konjugiranim dijenima:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Hidrogeniranje aromata: Pi veze benzenskog prstena su prekinute, a atomi vodika dodani su ugljiku koji stvara te veze.
Ova vrsta ukupne hidrogenacije prikazana je u nastavku:

Ukupna reakcija hidrogeniranja benzena
- Hidrogeniranje ciklana: Dolazi do stvaranja alkana.
Primjer: Hidrogeniranje ciklopropana:
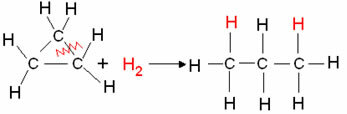
Reakcija hidrogeniranja ciklopropana
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm