Atom je ime dato oblikovatelju materije (svemu što zauzima prostor i ima masu). Ovo su ime predložili grčki filozofi Demokrit i Leukip. Kemijski elementi, molekule, tvari a organske ili anorganske materijale tvore atomi.
U svojoj strukturi atom ima čestice (protone, neutrone i elektrone), što nije najmanji dio materije. Još, vaša vizualizacija nije moguća. Ono što je poznato o atomu vezano je uz znanstveno dokazane fizikalne, kemijske i matematičke aspekte.
Razvoj znanja o atomu uzrokovao je razvoj i poboljšanje nekoliko tehnologija.
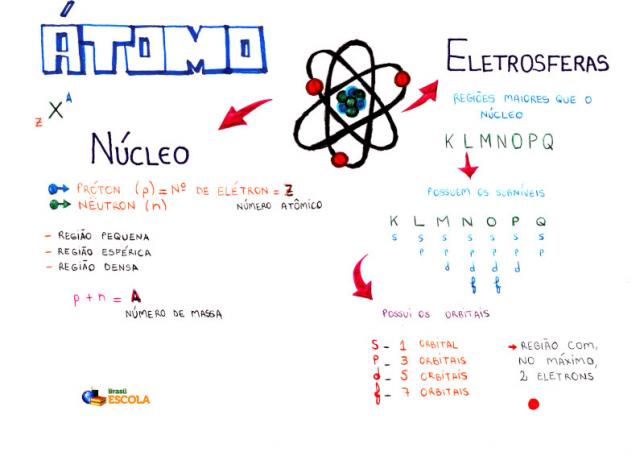
Osnovni sastav atoma
Jezgra: gušće područje atoma i sadrži protone i neutrone;
Razine energije: regije koje okružuju jezgru i koje sadrže podrazine, orbitale i elektrone. Postoji sedam energetskih razina koje su predstavljene slovima K, L, M, N, O, P i Q;
Podrazine energije: su regije u kojima se nalaze orbitale. Prisutni su na svim razinama i predstavljeni su slovima (s, p, d f). Njegova količina ovisi o svakoj razini: K (ima s podrazina), L (ima s i p podrazinu), M (ima s, p i d podrazinu), N (ima podrazine s, p, d i f), O (ima podrazine s, p, d i f), P (ima podrazine s, p i d) i Q (ima podrazine s i P);
Atomske orbitale: regije koje će najvjerojatnije pronaći elektron. Svaki podnivo ima različit broj orbitala: s (jedna orbitala), p (tri orbitale), d (pet orbitala) i f (sedam orbitala);
protoni: pozitivne čestice (predstavljene p);
elektroni: negativne čestice koje također imaju valno ponašanje (predstavljene s e);
neutronima: nenabijene čestice koje smanjuju odbojnost između protona u jezgri (predstavljene s n).
Mapa uma: Atom
* Za preuzimanje mape uma u PDF-u, Kliknite ovdje!
prikaz atoma
Najjednostavniji način predstavljanja atoma je upotreba kratice kemijskog elementa koji tvori. Skraćenica Se, na primjer, predstavlja sve atome koji tvore kemijski element selen.
Skraćenica koja predstavlja atom i dalje može pružiti dvije važne informacije: atomski broj (predstavljen slovom Z i uvijek na lijevoj strani dnu kratice atoma) i maseni broj (predstavljen slovom A, koji se može postaviti na lijevoj ili desnoj strani na vrhu kratice od atom).
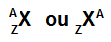
Skraćenica od atoma s masenim brojem i atomskim brojem
atomski broj (Z): označava broj protona prisutnih u jezgri atoma i broj elektrona (e) prisutnih u razinama energije.
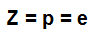
Formula koja ukazuje na reprezentativnost atomskog broja
Masni broj (A): označava masu prisutnu u jezgri atoma, koja je rezultat zbroja broja protona (p) i broja neutrona (n).

Formula koja ukazuje na reprezentativnost masenog broja
Atomske sličnosti
Atomi istog kemijskog elementa ili različitih kemijskih elemenata mogu se usporediti u smislu broja protona, elektrona, neutrona i mase, klasificirajući se na sljedeći način:
a) Izotopi
Oni su atomi koji imaju:
isti atomski broj;
isti broj protona;
različiti maseni broj;
različit broj neutrona;
Primjer:
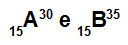
Atomi A i B su izotopi
Atomi A i B su izotopi jer:
Atom A ima 15 protona, atomski broj jednak 15, 15 elektrona, 15 neutrona i maseni broj jednak 30.
Atom B ima 15 protona, atomski broj jednak 15, 15 elektrona, 20 neutrona i maseni broj jednak 35.
b) izobare
Oni su atomi koji imaju:
različiti atomski brojevi;
različit broj protona;
različit broj elektrona;
isti maseni brojevi;
različit broj neutrona.
Primjer:
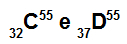
Atomi C i D su izobare
Atomi C i D su izobarični jer:
Atom C ima 32 protona, atomski broj jednak 32, 32 elektrona, 23 neutrona i maseni broj jednak 55.
Atom D ima 37 protona, atomski broj jednak 37, 37 elektrona, 18 neutrona i maseni broj jednak 55.
c) Izotoni
Oni su atomi koji imaju:
različiti atomski brojevi;
različit broj protona;
različit broj elektrona;
različiti maseni brojevi;
isti broj neutrona.
Primjer:
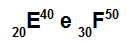
Atomi E i F su izotopi
Atomi E i F su izotopi jer:
Atom E ima 20 protona, atomski broj jednak 20, 20 elektrona, 20 neutrona i maseni broj jednak 40.
Atom F ima 30 protona, atomski broj jednak 30, 30 elektrona, 20 neutrona i maseni broj jednak 50.
d) Izoelektronika
Oni su atomi koji imaju:
isti broj elektrona.
BILJEŠKA: izoelektronski atomi također mogu imati isti maseni broj (izobare), isti broj neutrona (izotoni) ili isti broj protona (izotopi).
Primjer:
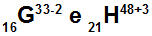
Atomi G i H su izoelektronski
Atomi G i H su izoelektronski jer:
Atom G ima 16 protona, atomski broj jednak 16, 18 elektrona (znak -2 označava da ima dva elektrona više od broja protona), 17 neutrona i maseni broj jednak 33.
Atom H ima 21 protona, atomski broj jednak 21, 18 elektrona (znak +3 znači da ima tri elektrona manje od broja protona), 27 neutrona i maseni broj jednak 48.
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm


