THE konstanta ionizacije daje Voda(Kw), O vodikov potencijal(pH) to je hidroksilni potencijal (pOH) oni su mjere važno za izračune koji uključuju kemijska ravnoteža u kiselim i bazičnim otopinama, kao i u određivanju koncentracije H iona+ i oh- dotičnih rješenja.
Što je Kw?
Jonski proizvod vode ili Kw (ovo wsredstva voda - voda, na engleskom), konstanta je koja se koristi za predstavljanje ravnoteža nastala samoionizacijom vode. Čak i s vrlo malom brzinom, voda ionizira stvarajući H ione+ i oh-, prema sljedećoj kemijskoj jednadžbi:
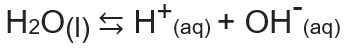
Analizirajući jednadžbu, shvaćamo da kada ionizacija iz molekule čiste vode stvara se ion H.+ i OH ion-, odnosno koncentracija ovih iona uvijek će biti ista. Čak i kada postoji porast temperature, što uzrokuje povećanje brzine ionizacije, koncentracije ostaju iste.
Pročitajte i vi:Energija jonizacije
Na temelju eksperimentalnih mjerenja izračunata je koncentracija H iona+ i oh- (što je rezultat samoionizacije vode) pri 25 ° C i vrijednosti 1. 10-7
mol / L. To je, od ukupno 1 milijarde molekula vode, samo dva se podvrgavaju ionizaciji. To pokazuje da čista voda ima nizak stupanj ionizacije i objašnjava vrlo nizak Električna vodljivost čiste vode.Uzimajući u obzir gore prikazano, možemo napisati izraz konstante vodne bilance:

Korištenje vrijednosti koncentracije H iona+ i oh- na 25 ° C, možemo izračunati vrijednost Kw:
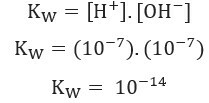
Kao što je ranije rečeno, ova vrijednost Kw mijenja se s porastom temperature, kao što je prikazano u donjoj tablici:
T (° C) |
Kw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
Da biste saznali više o ovoj temi, pročitajte naš tekst: Jonski proizvod vode.
Što su pH i pOH?

kratica pH sredstva vodikov potencijal a stvorio ga je danski biokemičar Soren Sorensen, 1909., kako bi se olakšao rad s koncentracije vodikovih iona [H+], koji se obično izražavaju u decimalnim brojevima. Da biste saznali više o ovoj temi, pročitajte naš tekst: Što je pH?
Ova vrsta zapisa označava sadržaj H iona+ prisutna u otopini a definiran je matematičkim izrazom:
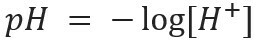
Slično tome, možemo definirati pOH ili hidroksilnog potencijala, što nam govori o Sadržaj OH iona- prisutna u otopini. Njegov matematički izraz je:
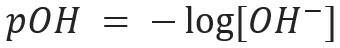
U vodenoj otopini uvijek će biti H iona+ i oh- (zbog ionizacije koju trpi voda) koja će se koristiti za karakterizaciju otopine u kisela ili Osnovni, temeljni. Što više H iona+ ima ga u otopini, što će biti kiselija. Posljedično tome, prisutnost OH iona- u rješenju će to učiniti osnovnijim. Ako postoji ravnoteža u količini ovih iona, otopina će se klasificirati kao neutralan.
pH skala
Prikazana je pH skala s vrijednostima u rasponu od 0 do 14 (vrijednosti izmjerene na 25 ° C). Pogledajte pH ljestvicu na slici ispod:

Što je pH nižirješenja,veća je njegova kiselost, i što je bliže kraju ljestvice, odnosno bliže 14, to će veći biti njezin osnovni karakter. Na primjer, limunov sok ima pH 2, dok izbjeljivači imaju pH 12.
Kako izračunati pH i pOH
poznavanje koncentracija iona, možemo izračunajte vrijednosti pH i pOH otopina i, znajući potencijalne vrijednosti, izračunavamo koncentracija iona u otopinama. U tu svrhu koriste se sljedeći izrazi:
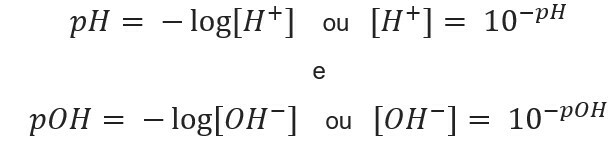
Idemo na primjere:
Primjer 1
Ako želimo znati pH otopine s [H+] = 0,001 mol / L, samo upotrijebite prethodno predstavljenu formulu:
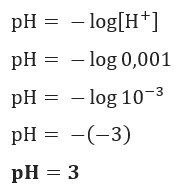
Primjer 2
Sada, kako bismo saznali kolika je koncentracija OH- otopine s pOH = 5, samo zamijenite vrijednost u sljedećoj formuli:

Ako primijenimo istu ljestvicu potencijala za ionsku ravnotežu vode, imat ćemo:
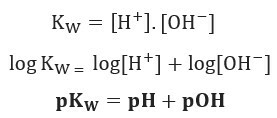
Kao što je navedeno, na 25 ° C, Kw = 10-14. Stoga:

Ovim možemo izračunati pOH otopine na temelju njezinog pH. Ako imamo otopinu s pH 3, tada će njen pOH biti 11.
Znati više: Neutralni, kiseli i bazični mediji
riješene vježbe
Pitanje 1 (UEFS-BA) Koncentracija OH iona–(ovdje) u datoj otopini amonijevog hidroksida, na 25 ° C, jednako je 1,10–3 mol / L. PP ovog rješenja je:
a) 0
b) 1
c) 3
d) 11
e) 13
Rješenje: Slovo C. Ako imamo [OH–] = 10–3 mol / L, tako da će vaš pOH biti jednak 3.
Izgled:
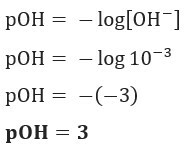
Pitanje 2 (UEA-AM) Uzmite u obzir sljedeće podatke dobivene na etiketi mineralne vode u gradu Porto Seguro (BA):
nitrata 1,45 mg / L
pH pri 25 ° C 4,51
Ova mineralna voda je
a) kisela i ima [H+] –].
b) kisela i ima [H+]> [OH–].
c) neutralan i ima [H+] = [OH–].
d) osnovni i ima [H+]> [OH–].
e) osnovni i ima [H+] –].
Razlučivost: Slovo B. Kako je pH mineralne vode naveden na naljepnici manji od 7, možemo reći da je kisela otopina i, prema tome, koncentracija H iona+ je veći od OH-a-.
Pitanje 3 (UEA-AM) Jedan od načina brzog dobivanja plinovitog vodika u laboratoriju je reakcija metalnog cinka u prahu s klorovodičnom kiselinom (HCl), u koncentraciji od 1,0 mol / L:
Zn (s) + 2 HCl (vod.) → ZnCl2 (vodeno) + H2 (g)
Uzimajući u obzir da je klorovodična kiselina 100% ionizirana i da je otopina na 25 ° C, ispravno je tvrditi da je pH otopine solne kiseline spomenute u tekstu
- 0
- 1
- 3
- 13
- 14
Rješenje:Slovo A. PH otopine možemo izračunati pomoću koncentracije HCl navedene u tekstu, budući da je koncentracija [H, jer je 100% ionizirana+] bit će isti, jer za svaku ioniziranu molekulu HCl jedan H ion+ generirat će se. Stoga:
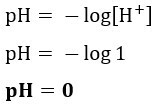
Napisao Victor Ferreira
Učitelj kemije

