entropija je a veličinatermodinamika povezano s nepovratnost stanja fizikalnog sustava. Obično se povezuje sa stupnjem "poremećaj" ili "slučajnost”Sustava. Prema jednoj od izjava 2. zakon termodinamike:
“U toplinski izoliranom sustavu, mjerenje entropije uvijek bi se trebalo povećavati s vremenom, sve dok ne dosegne svoju maksimalnu vrijednost. "
Drugim riječima, entropija može izmjeriti značenje "strijela vremena”Sustava. Kad vidimo slike u nastavku, intuitivno znamo da je početno stanje sustava prikazano slikom lijevo, od najvećih organizacija:
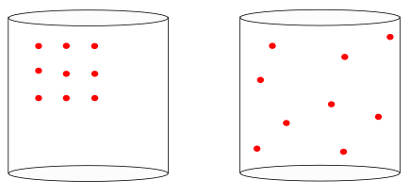
Gledajući prethodnu sliku, znamo da je najvjerojatnija konačna konfiguracija ona u kojoj imaju atomi brzine u svim smjerovima, kao i slučajni položaji. U tome je i entropija: a mnoštvo stanja sustava mora se uvijek povećavati.
Primjeri
Koja je od postavki u nastavku vjerojatnije da se vremenom promatra za raspored cigle?

U prvoj konfiguraciji, mnoštvo stanja blokova je malo: svi su raspoređeni u smjervodoravno, paralelno jedno drugo. S vremenom ili djelovanjem agensa očekuje se njegova konfiguracija
odrasti u broj u Države, favorizirajući ponedjeljakkonformacija, prikazano na slici desno. Mogu se navesti i drugi primjeri:Kad se obloga s ledom stavi u posudu sa većetemperatura, temperatura mu raste dok ne dosegne toplinska ravnoteža. U tom se trenutku led može topiti. Ponovnim uzimanjem topline iz ledenog bloka, koji je sada u državi tekućina, može ponovno postati čvrst, ali njegova konformacija neće imati istu organizaciju koji je prethodno predstavljen.
Kada otvarate bočicu parfema, vrućina vam može pomoći difuzija vašeg molekule, šireći sadržaj parfema cijelom dužinom sobe. Ne može se očekivati suprotno, jer uklanjanje topline ne bi pospješilo povratak molekula u tikvicu.
Matematička definicija entropije
THE matematička definicija entropije daje se omjerom količine topline (P) prenesena između dva dijela toplinski izoliranog sustava, u džula (J), po apsolutnoj temperaturi, u Kelvin (K):

S = Entropija (J / K)
ΔQ = Količina topline (J)
T = Apsolutna temperatura (K)
Gore navedena definicija vrijedi za izotermni procesi, odnosno u kojima postoje izmjene topline toliko male (ili spore) da nisu u stanju promijeniti temperaturu sustava. Definicija entropije je dakle beskonačno malo (beskrajno mali dio).
Koncept entropije možemo razumjeti i na sljedeći način: biti sustav koji čine dva dijela istog plina, u mnogo različitihtemperaturama, moguće je izdvojiti neku količinu raditi od njega premješta neke klip ili ručica, na primjer. Međutim, tijekom vremena, dijelovi ovog plina će težiti ravnotežatoplinska. Ako više ne postoji razlika u temperaturi, čak i sa svom tamo prisutnom energijom, neće biti moguće izdvojiti nijednu raditikoristan od njega.
Napisao Rafael Hellerbrock
Diplomirao fiziku
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm
