THE hibridizacija ugljika sp-tipa to se događa samo kad napravi dvije pi veze (π) i dvije sigma veze (σ). U ovom slučaju postoje dvije mogućnosti: ugljik može stvoriti dvije dvostruke veze ili jednostruku i trostruku vezu, kao što je prikazano dolje:
Tekst "hibridizacija tipa sp3”Detaljno pokazuje kako se odvija hibridizacija ugljika. Podsjećanje: hibridizacija je "miješanje" čistih atomskih orbitala, koje potječu od hibridnih atomskih orbitala, međusobno ekvivalentne, ali različite od izvornih čistih orbitala. Dakle, to se događa na ugljičnim orbitalama koje su izvorno bile predstavljene ovako:
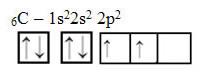
Međutim, primanjem energije, elektron (prikazan strelicom) iz 2s orbitale promovira se u 2p orbitalu:
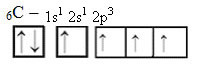
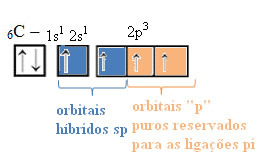
Na taj način ugljik ima četiri nesparene orbitale, koje mogu stvoriti četiri kovalentne veze, a ne samo dvije.
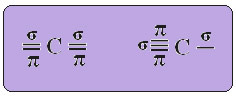
U slučaju hibridizacije sp-tipa, znamo da će dvije veze biti pi; one se javljaju u čistim orbitama "p", dok će ostale dvije orbitale, koje su sp hibridi, stvoriti preostale sigma veze.
Prostorni prikaz ove hibridizacije između s i p orbitale, koja dovodi do hibridne sp orbitale, može se predstaviti na sljedeći način:
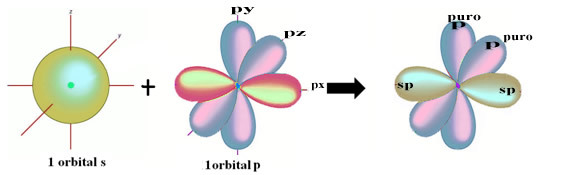
Na gornjoj je slici vrlo jasno da postoje dvije čiste orbitale koje će stvoriti pi veze.
Da biste razumjeli kako se to događa, uzmimo za primjer molekulu plina cijanida (HCN), koja se u Sjedinjenim Državama koristi u plinskim komorama za zatvorenike osuđene na smrtnu kaznu. Njegova strukturna formula dana je:
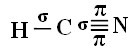
Što se tiče ugljika, njegove su atomske orbitale već prikazane, sada pogledajte orbitale vodika i dušika:
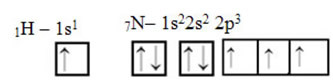
Imajte na umu da je nespareni vodikov orbital koji će izvoditi sigma vezu "s", koji je prostorno predstavljen krugom; a dušične orbitale su tipa „p“, predstavljene s tri dvostruka jajašca (svaki u prostornom polju: x, y, z). Dakle, struktura molekule HCN predstavljena je na sljedeći način:
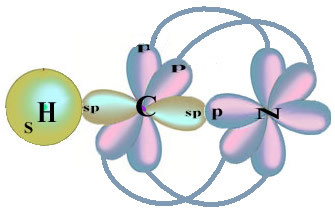
Što se tiče vrste veza koje postoje u ovoj formaldehidnoj strukturi, imamo:
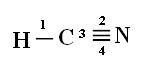
Veze: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
