difuzija i izljev dva su zakona koja je predložio škotski kemičar Thomas Graham u 19. stoljeću, na temelju svojih studija o mješavine plina i ponašanje plinovi kad prolazi kroz stijenke kontejnera.
Među zapažanjima Thomas Grahama o ponašanju plinova u odnosu na difuziju i izljev, možemo istaknuti sljedeće:
Plin uvijek ima tendenciju prolaska kroz male rupe prisutne u krutom stanju;
Što je veći masa molekula plin, to je veća njegova poteškoća pri prolasku kroz rupe čvrste tvari;
Što je gustoća plina manja, to je veća njegova brzina kretanja;
Što je viša temperatura kojoj je plin podvrgnut, to je veća brzina kojom se širi u okoliš ili prolazi kroz otvor;
- Plin nikada ne ostaje statičan na određenom mjestu.
Difuzija
Difuzija to je fizički fenomen koji se sastoji u sposobnosti plina da se difundira (odnosno širi) kroz prostor područja ili unutar spremnika. Iz tog razloga možemo reći da se u prostoru plin nikada ne ograničava na jedno mjesto.

Prikaz pojave emisije
Uz to možemo definirati i difuzija još uvijek kao kapacitet koji jedan plin mora miješati s drugim kada se stavi u isti spremnik, tvoreći homogenu plinovitu smjesu.
Primjer je kada plinovi izlaze iz ispušnih plinova vozila. Koliko god bili otrovni, ljudima ne uzrokuju kratkotrajnu štetu, jer se šire po atmosferskom zraku, posljedično smanjujući njihovu koncentraciju.
Izljev
Izljev to je fizička pojava koja se sastoji u prolasku plina kroz rupe koje postoje u stijenkama određenog spremnika, odnosno sastoji se u izlazu plina iz jedne okoline u drugu.

Prikaz pojave izljeva
Primjer je kada se baloni napuhuju za zabavu, a sljedeći dan svi se ispušu, sve zbog zraka koji izlazi kroz rupe u balonima.
Proračuni povezani s difuzijom i izljevom
Prema jednadžbama koje je predložio Graham, možemo izračunati brzinu kojom plin djeluje difuzija ili izljev. Prema Grahamu, brzine difuzije i izljeva dvaju plinova pomiješanih u spremniku su uvijek obrnuto proporcionalni kvadratu njihove relativne gustoće ili molarnih masa.
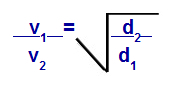
Grahamov zakon s obzirom na gustoću
v1 = brzina (izljev ili difuzija) plina 1 u smjesi;
v2 = brzina (izljev ili difuzija) plina 2 u smjesi;
d1 = gustoća plina 1 smjese;
d2 = gustoća plina 2 smjese;
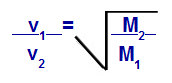
Grahamov zakon o molarnoj masi
v1 = brzina (izljev ili difuzija) plina 1 u smjesi;
v2 = brzina (izljev ili difuzija) plina 2 u smjesi;
M1 = molarna masa plina 1 smjese;
M2 = molarna masa plina 2 u smjesi.
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
