Vas esteri su oksigenirani organski spojevi koji nastaju kemijskom reakcijom između a karboksilna kiselina to je alkohol. Predstavite funkcionalnu skupinu (koju čine dva atoma kisika i dva radikali R) predstavljeni u nastavku:
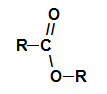
Opća funkcionalna skupina estera
Strukturno, ono što karakterizira ester to je prisutnost nekog alkilnog radikala koji je izravno vezan za atom kisika. U ovom slučaju, radikal (R) vezan za ugljik - koji je pak dvostruko vezan za kisik - može biti alkilni radikal ili atom vodika.
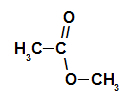
Ugljični lanac estera
reakcija esterifikacije
radi se o kemijska reakcija koja vodi ester i molekulu vode iz interakcije između karboksilne kiseline i bilo kojeg alkohola, kao u donjoj jednadžbi:
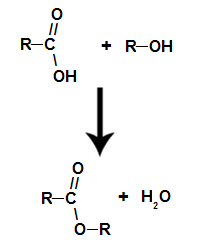
Kemijska jednadžba koja predstavlja nastajanje estera
Tijekom esterifikacije hidroksilna skupina (OH) alkohola djeluje s vodik (H) ionizirajuće iz hidroksila kiseline i tvori molekula vode.
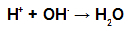
Skupine molekula vode u esterifikaciji
već ono ester nastaje povezivanjem radikala (R) alkohola s kisikom, koji ostaje nakon hidroksila kiseline nakon stvaranja vode.
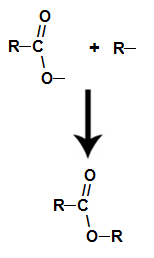
Stvaranje molekule estera
Karakteristike estera
Glavna fizikalna svojstva koje je predstavio esteri:
Imaju arome voća i cvijeća;
niski esteri molekulska masa oni su tekući na sobnoj temperaturi, a oni s velikom molarnom masom su čvrsti;
U usporedbi s alkoholima i karboksilnim kiselinama, esteri imaju niža tališta i vrelišta;
U usporedbi s vodom, esteri niže molarne mase manje su gusti;
Esteri donje molarne mase su polarni, a oni veće molarne mase nepolarni;
U polarnim esterima prevladavaju sile trajni dipol; u nepolarnim prevladavaju sile inducirani dipol;
Esteri s nižom molarnom masom slabo su topljivi u vodi, a oni veće mase nisu topljivi u vodi.
Pravilo imenovanja Estera
Prije upotrebe pravila imenovanja a ester, neophodno je zapamtiti da ovaj spoj nastaje spajanjem dvaju dijelova, od kojih jedan dolazi karboksilne kiseline (u crvenoj) i druge alkohola (u plavoj), kao što je prikazano slikom a slijediti:
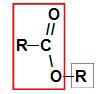
Identifikacija dijelova koji potječu od estera
Prema Međunarodnoj uniji čiste i primijenjene kemije (IUPAC), službeno pravilo za imenovanje estera je:
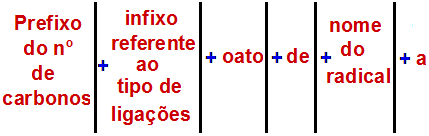
Pravilo imenovanja Estera
Bilješka: Prefiks i infiks uvijek odgovaraju dijelu karboksilne kiseline, a radikal alkoholnom dijelu.
U nastavku pogledajte neke primjere primjene pravila imenovanja za estere:
1. primjer: esencija maline
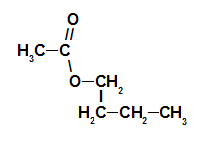
Strukturna formula estra esencije maline
Za imenovanje ovog estera koristimo:
Br. PrefiksO ugljika: et, budući da kiselina u obliku ima dva ugljika;
Infiks o vrsti veza: an, jer formirajuća kiselina ima samo jednostruke veze između ugljika;
čin;
u;
Radikal: butil, imajući četiri ugljika u nizu;
The.
Dakle, naziv estera koji odgovara esenciji maline je butil etanoat.
2. primjer: esencija borove šišarke
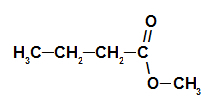
Strukturna formula estera borove šišarke
Za oblikovanje imena ovog estera koristimo:
Br. PrefiksO ugljika: ali, budući da tvorba kiseline ima četiri ugljika;
Infiks o vrsti veza: an, jer formirajuća kiselina ima samo jednostruke veze između ugljika;
čin;
u;
Radikal: metil, jer alkohol koji tvori ima samo jedan ugljik;
The.
Dakle, naziv estera koji odgovara esenciji borove šišarke je metil butanoat.
3. primjer: esencija jagode
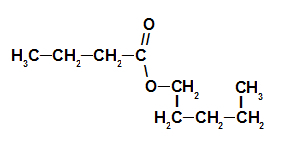
Struktura strukturne formule estrata jagode
Za imenovanje ovog estera koristimo:
Br. PrefiksO ugljika: ali, budući da kiselina u obliku ima četiri ugljika;
Infiks o vrsti veza: an, jer formirajuća kiselina ima samo jednostruke veze između ugljika;
čin;
u;
Radikal: pentil, jer alkohol koji tvori ima pet ugljika u nizu;
The.
Dakle, naziv estera koji odgovara esenciji jagode je pentil butanoat.
Upotreba estera
Esteri su dobro poznati po svojoj upotrebi kao aroma u prerađenoj hrani, odnosno tvarima koje simuliraju karakterističan okus i aromu prirodne hrane, poput voća. Nadalje, esteri se i dalje koriste u proizvodnji lijekova, kozmetike, parfema i voskova.
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ester.htm

