Na reakcije organskog dodavanja su vrlo česti i proučavani. Vrijedno je podsjetiti da je to vrsta reakcije koja predstavlja osnovni i dominantni mehanizam prekinuti vezu ili veze, pi tako da dva ili više atoma mogu početi biti dijelom lanca.
Primjer korištenja adicijskih reakcija povezan je s proizvodnja margarina. Ovaj proizvod, tako čest u svakodnevnom životu ljudi, nastaje hidrogenacijom (reakcijom dodavanja) biljnih ulja koja su prisutna pi veze u svom ustavu.
Vrste reakcija adicije su:
hidrogeniranje (dodavanje atoma vodika);
Halogenizacija (dodatak atoma halogena: Cl2, br2, Ja2 i F2);
Reakcija s halidom (dodatak anorganskih hidracida koji sadrže halogen poput HCl, HI, Hbr i HF);
Hidratacija (dodatak hidronija, H+i hidroksil, OH-).
Tijekom dodavanja od hidratacija ili halogenidom, The Vladavina Markovnikova za nas je presudno predvidjeti proizvode koji će nastati. U ovom pravilu imamo da atom atoma hidronij (H+) iz anorganskog hidroksida ili vode će se dodati u više hidrogeniranog ugljika
dvostruke veze. već ono halogen (Cl, Br, I, F) halogenida ili hidroksil (OH-) vode će se dodati u manje hidrogeniranog ugljika od pi veze. Pogledajte primjer primjene ovog pravila u sljedećoj jednadžbi: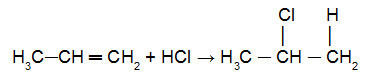
Reakcija proprena s HCl
U ovoj jednadžbi možemo vidjeti da atom atoma (Cl) dodan je manje hidrogeniranom ugljiku iz pi link, dok je atom od hidronij (H+) je dodan najhidrogeniranom atomu ugljika u pi link.
samo je jedan iznimka na pravilo Markovnikova: Kharashova reakcija. U njemu se događa inverzija, odnosno atom hidronij (H+) bit će dodan u manje hidrogeniranog ugljika daje pi link, to je halogen (Br) halogenida će biti dodan u više hidrogeniranog ugljika daje pi link. Potankost je da se ova reakcija događa samo na jedan način:
Prisutnost organskog peroksida;
Upotreba Hbr.
BILJEŠKA: ako ti uvjeti nisu ispunjeni, Vladavina Markovnikova koristit će se normalno.
Pogledajte dolje prijavu Kharashova reakcija u propilenu:
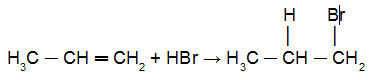
Reakcija propena s HBr u prisutnosti peroksida
BILJEŠKA: Vrijedno je napomenuti da je organski peroksid spoj koji nužno ima skupinu (R─O─O─R) u svom sastavu. Najčešće korišteni organski peroksid u Kharashovim reakcijama potječe od karboksilnih kiselina i ima sljedeću strukturu:
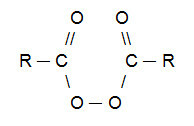
Opća strukturna formula organskog peroksida
Objašnjenje Kharashove reakcije za preokret pravila Markovnikova leži u činjenici da se u početku peroksid razgrađuje (korak 1), tvoreći slobodne radikale s dva atoma kisika koji napadaju vodik HBr (korak 2). Iz tog razloga, tko će u početku napadati molekulu alkena, bit će Br (korak 3). Tek nakon što se vodik veže za alkenski lanac. Slijedite slijed činjenica:
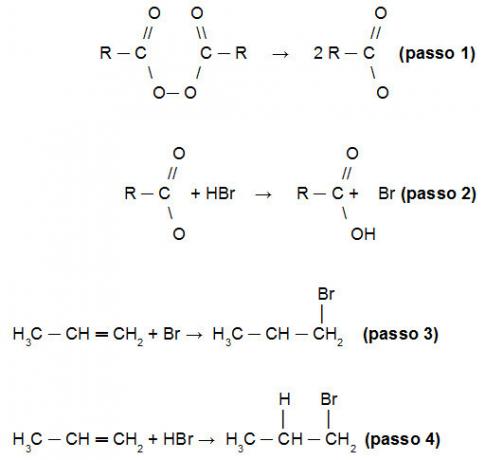
Demonstracija mehanizma Kharashove reakcije
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/reacao-kharash.htm
