Goriva koja se koriste u većini automobila su benzin i etanol. Potpuno izgaranje ta dva goriva stvara ugljični dioksid (CO2 (g)) i vode (H2O). Nažalost, nepotpuno izgaranje i nečistoće prisutne u alkoholu i benzinu mogu stvoriti tvari koje vrlo zagađuju okoliš. U slučaju benzina, ugljični monoksid (CO(g)); ugljikovodici (spojevi koji se sastoje od ugljika i vodika), poput etana (C2H6 (g)); i dušikovi oksidi (NOx), uglavnom dušikov monoksid (NO) i dušikov dioksid (NO2 (g)).
Dakle, da bi se izbjeglo povećanje zagađenja zraka, svi automobili trebaju opremu tzv katalitički pretvarač ili katalitički pretvarač, koji je uređaj protiv onečišćenja, koji ima funkciju obrade tih plinova koje ispušta motor s unutarnjim izgaranjem i pretvaranja u manje štetne plinove. U tu svrhu se u nekim industrijskim procesima koriste i katalitički pretvarači.
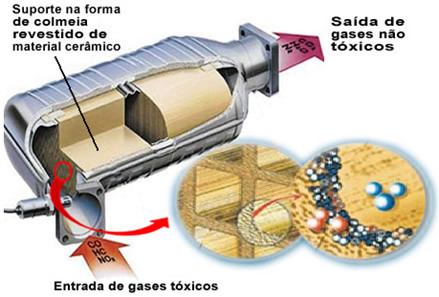
Spomenuti onečišćujući plinovi napuštaju motor i ulaze u katalizator, prolazeći kroz neku vrstu "košnice", čije su stanice uglavnom izrađene od keramičkog ili metalnog materijala koji je presvučen glinicom (aluminijev oksid - Al
2O3). Ovaj oblik saća, sa sićušnim kanalima, važan je jer osigurava veliku kontaktnu površinu plinova, čineći ih bržom reakcijom.Ali pravi katalizator je metal koji se nalazi na vrhu aluminijevog oksida. Obično se koriste metali paladij, rodij, platina ili molibden. Također možete miješati ove metale i koristiti legure. Na primjer, u slučaju benzina obično se koristi slitina paladija i torija; u slučaju etanola koristi se druga slitina paladija i molibdena. Ti metali izvode heterogenu katalizu s plinovima koji zagađuju.
heterogena kataliza to je vrsta reakcije u kojoj katalizator stvara s reaktantima (u ovom slučaju zagađujućim plinovima) višefazni sustav. To je zato što se katalizator adsorbira, odnosno zadržava molekule reaktanata na svojoj površini, slabeći njihove veze i ubrzavajući reakciju.
Dakle, metali katalizatora transformiraju onečišćujuće tvari poput CO i NOx u netoksičnim plinovima kao što je CO2, H2O, o2 i ne2. Pogledajte neke od ovih reakcija u nastavku i primijetite da kroz njih dolazi do oksidacije ugljikovodika i CO (dobiven nepotpunim izgaranjem) i također redukcija dušikovih oksida u plinoviti dušik (N2):
2 CO(g) + 2 NE(g) → 2 CO2 (g) + 1 N2 (g)
2 CO(g) + 1 O2 (g) → 2 CO2 (g)
2C2H6 (g) + 7 O.2 (g) → 4 CO2 (g) + 6 H2O(v)
2 NE2 (g) +4 CO(g) → 1 N2 (g) + 4 CO2 (g)
2 NE2 (g) → 1 N2 (g) + 2 O2 (g)
2 NE(g) → 1 N2 (g) + 1 O2 (g)
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm