Među složenostima atomskog proučavanja je određivanje veličine atoma ili, bolje, atomska zraka. Ovo periodično svojstvo opisuje udaljenost od jezgre do najudaljenijeg elektrona njezinih elektroničkih razina. Da bi se to odredilo, izvodi se aritmetički prosjek udaljenosti između jezgri dvaju atoma koji tvore jednostavnu tvar, na primjer.
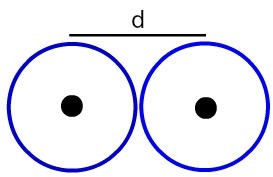
Prikaz udaljenosti između dvije atomske jezgre
Odredimo atomski radijus (RA) atoma prikazanih na slici. Da biste to učinili, samo podijelite udaljenost između jezgri s 2:
RA = d
2
O proučavanje atomskih zraka je važan jer favorizira razumijevanje nekih fizičkih događaja (gustoća, točka fuzija, točka ključanja i energija ionizacije) i kemikalije (kemijske veze) koje nastaju s atoma.
Analizom periodnog sustava možemo procijeniti je li atom veći ili manji u odnosu na drugi, a time i utvrditi ima li veću ili manju lakoću uklanjanje jednog ili više elektrona s njihovih orbitala. THE procjena i određivanje atomskog radijusa u periodnom sustavu izvodi se prema dva osnovna kriterija:
a) Broj razina energije (obitelji ili skupine / vertikalni stupovi)
Znamo da atomi mogu imati do sedam energetskih razina (K, L, M, N, O, P, Q) i da svaki kemijski element nalazi se u obiteljima ili skupinama (vertikalni stupci) i u razdobljima (stupci vodoravno). Razdoblja označavaju broj razina koje element ima atom, a obitelj označava najenergičniji podrazina atoma. U skupini ili obitelji kemijski se elementi razlikuju po količini razine energije. Pogledajte donju tablicu:

Što je veći broj energetskih razina atoma, to je veći i njegov atomski radijus. Analizirajući gornju tablicu, može se vidjeti da francij ima najveći atom, jer ima sedam razina. Atom kalija, s druge strane, ima manji radijus jer ima četiri energetske razine. Slijedi usporedni prikaz između atoma francija i atoma kalija:
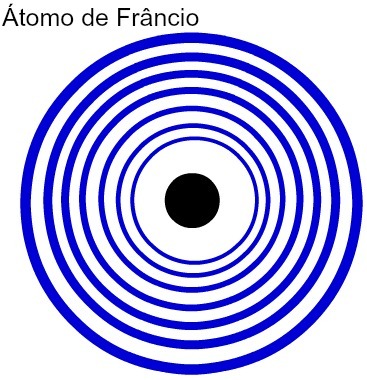
Prikaz sedam energetskih razina atoma Francija

Prikaz četiriju energetskih razina atoma kalija
Sljedeći dijagram prikazuje kako se povećava polumjer atoma u istoj obitelji ili grupi (vertikalni stupci) periodnog sustava. Što je veći broj razina, to je veći radijus, tj. na periodnom sustavu atomski radijus raste od vrha do dna:
Prikaz kako se atomski radijus povećava u obitelji periodnog sustava
b) Atomski broj (Z ili broj protona) u istom razdoblju (vodoravni stupac)
Kada kemijski elementi pripadaju istom razdoblju, njihovi atomi imaju jednaku razinu energije, ali količina protona unutar njihovih jezgri je različita. Slijedi slijed elemenata koji pripadaju četvrtom razdoblju periodnog sustava:
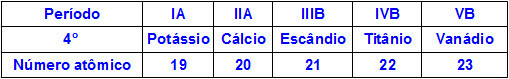
Svi atomi elemenata predstavljenih u gornjoj tablici imaju četiri energetske razine, ali svaki od njih ima različitu količinu protona u svojim jezgrama. Kako protoni unutar jezgre djeluju privlačno na elektrone prisutne u razinama energije, što je veća količina protona u jezgri, to je veća njihova privlačnost prema elektronima. Rezultat je približavanje nivoa prema jezgri, smanjujući veličinu atoma.
↑Z = ↓ Atomski radijus
↓Z = ↑ Atomski radijus
Dakle, možemo konstatirati da je atomski radijus elementa kalij veći od radijusa vanadija zbog manjeg broja protona.
Sljedeći dijagram predstavlja kako se povećava porast atomskog radijusa u istom razdoblju (vodoravna crta). Što je atomski broj manji, radijus je veći, odnosno atomski radijus u tablici raste zdesna ulijevo
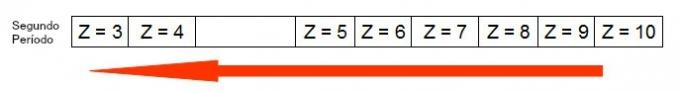
Prikaz kako se atomski radijus povećava u razdoblju periodnog sustava
Ja sam. Diogo Lopes Dia


