ionizacija je kemijski fenomen u kojem kisela tvar (čija je opća formula HX), kada se otopi u vodi, daje dva iona: hidronijev kation (H3O+ ili H+) i bilo koji anion (X-). Pojava je predstavljena iz jednadžbe. Izgled:
HX + H2O → H3O+ + X-
Tijekom ionizacije, samo ionizirani vodikovi iz kiselina pretvaraju se u hidronijeve katione, čimbenik koji također ovisi o ionizacijskom kapacitetu ove kiseline, odnosno o stupnju ionizacije (α). Dakle, ne stvara svi vodik hidronij, osim ako kiselina ima stupanj ionizacije jednak 100%.
Međutim, kad jesmo izgradnja jednadžbe ionizacije, ne uzimamo u obzir stupanj ionizacije kiseline, već količinu ionizirani vodikovi koje on predstavlja.
Kao opće pravilo, ionizirajući vodik smatramo svim vodikom koji je prisutan u hidracidi. U slučaju oksijakiselina, ioniziraju se samo vodikovi vezani za atome ugljika, što se može vidjeti u dolje prikazanoj strukturnoj formuli:
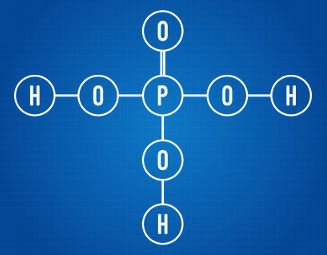
Fosforna kiselina ima tri vodika koja se mogu ionizirati
Analizirajući gornju strukturnu formulu, možemo vidjeti da dotična kiselina ima tri atoma vodika vezana za atome kisika. Kao takav ima ukupno tri vodika koji se mogu ionizirati.
Pogledajte neke primjere montaže jednadžbe jonizacije nekih kiselina:
Primjer 1: Bromovodična kiselina (HBr)
HBr + H2O → H3O+ + Br-
Bromovodikova kiselina je hidracidna kiselina koja u svom sastavu ima samo jedan vodik. Budući da se sav vodik u hidracidi može ionizirati, on nastaje samo kada se otopi u vodi jedan mol hidronijevog kationa to je bromid anion (Br-).
Primjer 2: Vodikov sulfid (H2S)
H2Y + 2 H2O → 2 H+ + S-2
Vodikov sulfid je hidracid s dva vodika u svom sastavu. Budući da se sav vodik u hidracidi može ionizirati, on se stvara, kad se otopi u vodi, dva mola hidronijevih kationa to je sulfidni anion (S-2). Za ovo smo koristili dva mola vode.
Primjer 3: manganska kiselina (H2MnO4)
H2MnO4 + 2 H2O → 2 H3O+ + MnO4-2
Manganska kiselina je oksida kiselina s dva vodika u svom sastavu. Kako se u oksijakiselinama samo vodik vezan za kisik ionizira - u slučaju manganske kiseline, dva vodika jesu - on će nastati kad se otopi u vodi, dva mola hidronijevih kationa to je manganat anion (MnO4-2). Za ovo smo koristili dva mola vode.
Primjer 4: Fosforna kiselina (H3PRAH3)
H3PRAH3 + 2 H2O → 2 H3O+ + HPO3-2
Fosforna kiselina je oksida kiselina u kojem su tri vodika. Kako se u oksijakiselinama samo vodik vezan za kisik ionizira - u slučaju fosforne kiseline, dva vodika jesu - on će nastati otapanjem u vodi, dva mola hidronijevih kationa to je fosfitni anion (HPO3-2). Za ovo smo koristili dva mola vode.
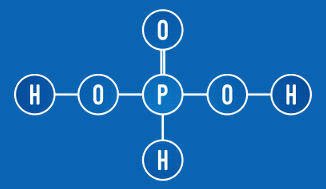
Fosforna kiselina ima dva vodika koja se mogu ionizirati (OH skupina)
Primjer 5: Borna kiselina (H3BO3)
H3BO3 + 3 H2O → 3 H+ + BO3-3
Borna kiselina je oksida kiselina s tri vodika u svom sastavu. Kako se u oksijakiselinama samo vodik vezan za kisik ionizira - u slučaju borne kiseline, tri vodika jesu - on će nastati otapanjem u vodi, tri mola hidronijevih kationa to je boratni anion (BO3-3). Za ovo smo koristili tri mola vode.
Primjer 6: Pirofosforna kiselina (H4Str2O7)
H4Str2O7 + 4 H2O → 4 H3O+ + P2O7-4
Pirofosforna kiselina je oksida kiselina s četiri vodika u svom sastavu. Kako se u oksijakiselinama samo vodik vezan za kisik ionizira - u slučaju borne kiseline, četiri vodika jesu - on će nastati otapanjem u vodi, četiri mola hidronijevih kationa to je anionpirofosfat (str2O7-4). Za ovo smo koristili četiri mola vode.
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/equacoes-ionizacao-dos-acidos.htm
