Prema obitelji periodnog sustava su vertikalne sekvence stola i okupljaju kemijski elementi sa sličnim kemijskim svojstvima. Takve su sličnosti posljedica prisutnosti jednakih količina valentnih elektrona za elemente grupirane u istoj obitelji. Obitelji obuhvaćaju reprezentativne elemente u skupinama 1 i 2, od 13 do 18 i prijelazne elemente u skupinama 1 do 12.
Pročitajte također:Transuranski elementi — kemijski elementi koje je stvorio čovjek koji dolaze nakon urana u periodnom sustavu
Sažetak obitelji periodnog sustava
Obitelji odgovaraju okomitim linijama Periodni sustav elemenata.
Poznate i kao grupe, obitelji u periodnom sustavu numerirane su brojevima od 1 do 18.
Kemijski elementi u istoj obitelji imaju slična kemijska svojstva.
Poznatost skupa elemenata objašnjava se istim brojem valentnih elektrona.
Reprezentativni elementi su podijeljeni u grupe 1, 2, 13, 14, 15, 16, 17 i 18. Svaka od ovih obitelji ima posebna imena.
Prijelazni elementi tvore jednu obitelj koja je podijeljena u skupine 3, 4, 5, 6, 7, 8, 9, 10, 11 i 12.
Organizacija obitelji periodnog sustava
Obitelji u periodnom sustavu su vertikalne sekvence tablice, odnosno stupce. Također poznate kao grupe, obitelji periodnog sustava označeni brojevima od 1 do 18, s lijeva na desno.
Smatra se da kemijski elementi koji zauzimaju isti stupac pripadaju istoj obitelji., zbog sličnosti njihovih kemijskih svojstava, što je posljedica činjenice da imaju isti broj elektroni na valentna ljuska. Na primjer, svi kemijski elementi obitelji 18 imaju osam elektrona u valentnoj ljusci (puna ljuska) i rijetko sudjeluju u kemijske veze.
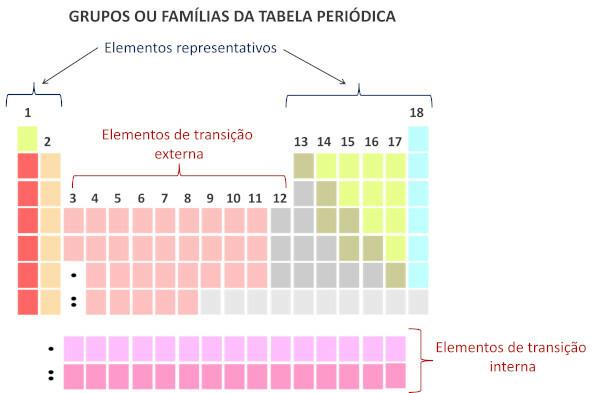
Prema suvremenom sustavu Međunarodna unija čiste i primijenjene kemije (Iupac), svaka skupina ili obitelj označena je brojem od 1 do 18, počevši s lijeva na desno u periodnom sustavu.
Važno je naglasiti da je stari IUPAC sustav usvojio alfanumerički sustav, sa slovima A i B za reprezentativne odnosno prijelazne elemente. Trenutno se ova vrsta nomenklature više ne koristi.
Nomenklatura obitelji periodnog sustava
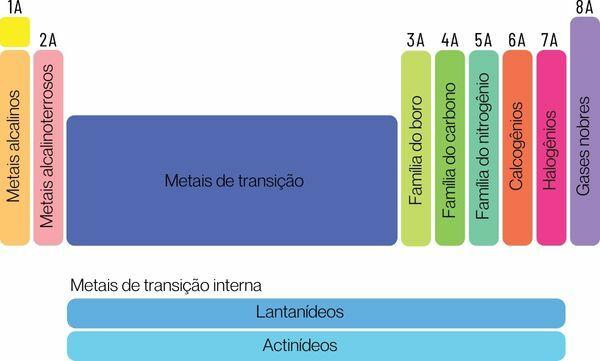
Kemijski elementi mogu se klasificirati u dvije velike obitelji: reprezentativni elementi i prijelazni elementi.
→ Reprezentativni elementi periodnog sustava
Reprezentativni elementi su podijeljeni u grupe 1, 2, 13, 14, 15, 16, 17 i 18. Svaka od ovih grupa ima određeni naziv, pod kojim može biti i poznata. Izgled:
Grupa 1: obitelj od metali alkalni.
Grupa 2: obitelj od zemnoalkalijski metali.
Grupa 13: obitelj bora ili zemljanih metala.
Grupa 14: obitelj ugljika.
Grupa 15: Obitelj dušika ili pnikogena.
Grupa 16: obitelji kisika ili halkogena.
Grupa 17: obitelj od halogeni.
Grupa 18: obitelj od plemeniti plinovi.
→ Prijelazni elementi periodnog sustava
Vas prijelazni elementičine jednu obitelj podijeljenu u skupine 3, 4, 5, 6, 7, 8, 9, 10, 11 i 12. Serije lantanida i aktinoida također su dio prijelaznih elemenata.
Prijelazni elementi svi su metalni i imaju slična kemijska svojstva, čak i da imaju različite elektrone u valentnoj ljusci i, prema tome, formirali bi jednu i veliku obitelj prijelaznih metala.
Kemijski elementi iz obitelji periodnog sustava
Svaka obitelj ili skupina sastavljena je od skupa kemijskih elemenata. Pogledajte opis kemijskih elemenata koji čine svaku obitelj:
Grupa 1:litij, natrij, kalij, rubidij, cezij, francij.
Grupa 2:berilijum, magnezij, kalcij, stroncij, barij, radio.
Grupa 3:skandij, itrij, serije lantanida i serije aktinoida.
Grupa 4: titanijum, cirkonijO, hafnij to je Rutherfordium.
Grupa 5:vanadij, niobij, tantal to je dubnij.
Grupa 6:krom, molibden, volfram to je seaborgium.
Grupa 7:mangan, tehnecij, renij to je bohrio.
Grupa 8: željezo, rutenij, osmij to je hasij.
Grupa 9:kobalt, rodij, iridij i meitnerij.
Grupa 10:nikal, paladij, platina i darmstadtio.
Grupa 11: bakar, srebro, zlato i roentgenij.
Grupa 12:cinkov, kadmij, Merkur i Kopernik.
Grupa 13: bor, aluminij, galij, indij i talij.
Grupa 14: ugljik, silicij, germanij, kositar, voditi i flerovium.
Grupa 15:dušik, fosfor, arsen, antimon to je bizmut.
Grupa 16:kisik, sumpor, selen, telur, polonij i livermorij.
Grupa 17: fluor, klor, brom, jod i astatin.
Grupa 18:helij, neon, argon, kripton, ksenon to je radon.
Važno: kemijski element vodik je poseban slučaj, jer unatoč tome što se nalazi uz grupu 1, nije dio obitelji alkalnih metala, budući da nema slična kemijska svojstva.
Znati više: Koji su radioaktivni elementi u periodnom sustavu?
Glavne karakteristike obitelji periodnog sustava
→ Grupa 1 ili obitelj alkalijskih metala
Oni su metalne čvrste tvari, sjajne i glatke.
Imaju visoku toplinsku vodljivost i visoku Električna vodljivost.
imati temperature relativno nisko talište.
Vrlo su reaktivni sa voda.
Sklonost stvaranju jednovalentnih kationa (naboj +1).
→ Grupa 2 ili obitelj zemnoalkalijskih metala
Oni su metalne čvrste tvari, sjajne i tvrđe u usporedbi s alkalnim metalima.
Lako oksidiraju.
Imaju visoku toplinsku vodljivost i visoku električnu vodljivost.
Imaju nešto više temperature taljenja u usporedbi s alkalnim metalima.
Reaktivni su s vodom.
Sklonost stvaranju dvovalentnih kationa (naboj +2).
→ Grupe 3 do 12 ili obitelj prijelaznih metala
Oni su najveća obitelj na periodnom sustavu.
Tvrde, sjajne metalne tvari.
Imaju visoku toplinsku vodljivost i visoku električnu vodljivost.
Gusta.
Visoke temperature taljenja.
može predstaviti drugačije oksidacijska stanja.
→ Grupa 13 ili obitelj bora
Imaju posredna svojstva između svojstava metala i ne metali.
Čvrsti su u uvjetima okoline.
Sklonost stvaranju trovalentnih kationa (naboj +3).
→ Grupa 14 ili obitelj ugljika
Imaju posredna svojstva između svojstava metala i nemetala.
Čvrsti su u uvjetima okoline.
Sklonost stvaranju četiriju veza.
Čvrsti su u uvjetima okoline.
Ugljik i silicij mogu tvoriti lančane veze.
→ Grupa 15 ili obitelj dušika
Imaju posredna svojstva između svojstava metala i nemetala.
Krutine u uvjetima okoline, s iznimkom dušika, koji je plin.
Dušik i fosfor temeljni su u živim organizmima.
Arsen je vrlo otrovan.
→ Grupa 16 ili obitelj kisika (halkogeni)
Imaju različita svojstva, mijenjajući se od nemetalnog do metalnog elementa kako idete niz obitelj.
Krutine u uvjetima okoline, s izuzetkom kisika, koji je plin.
Sklonost stvaranju dvovalentnih aniona (naboj -2).
→ Grupa 17 ili obitelj halogena
Oni su nemetali.
Prilično reaktivan.
Loši toplinski i električni vodiči.
U uvjetima okoline, fluor i klor postoje kao plinovi, brom je tekući, a jod čvrsta materija.
Sklonost stvaranju jednovalentnih aniona (naboj -1).
→ Grupa 18 ili obitelj plemenitih plinova
Oni su nemetali.
Vrlo su malo reaktivni, pa se mogu nazvati inertnim plinovima.
Postoje u obliku plinova.
Nemaju tendenciju formiranja ioni.
Periodni sustav i elektronička distribucija
Kemijski elementi koji pripadaju istoj obitelji ili skupini imaju slična kemijska svojstva jer imaju jednak broj elektrona u valentnoj ljusci.
Broj elektrona u valentnoj ljusci je relevantan, jer određuje tendenciju stvaranja kationa ili anioni, vrsta kemijske veze koja se stvara, energija uključena u kemijske reakcije, između ostalog karakteristike. Da bismo pronašli broj valentnih elektrona, potrebno je znati atomski broj elementa i izvedite svoj elektronska distribucija.
→ Elektronička distribucija reprezentativnih elemenata
Reprezentativni elementi imaju svoje najenergičnije elektrone u podrazinama s to je P elektroničkog sloja (n). Sljedeća tablica okuplja elektroničke konfiguracije povezane sa svakom obitelji reprezentativnih elemenata. uvjet n varira od 1 do 7 i predstavlja razinu energije koju zauzimaju valentni elektroni, što je ekvivalentno periodu (vodoravnoj liniji) periodnog sustava u kojem se element nalazi.
Elektronička distribucija reprezentativnih elemenata | ||
obitelji ili grupi |
Elektronička distribucija |
Primjer |
1 |
nas1 |
Li (Z=3): 1s2 2s1 |
2 |
nas2 |
Be (Z=4): 1s2 2s2 |
13 |
nas2 np1 |
B (Z=5): 1s2 2s22p1 |
14 |
nas2 np2 |
C (Z=6): 1s2 2s22p2 |
15 |
nas2 np3 |
N (Z=7): 1s2 2s22p3 |
16 |
nas2 np4 |
O (Z=8): 1s2 2s22p4 |
17 |
nas2 np5 |
F (Z=9): 1s2 2s22p5 |
18 |
nas2 np6 |
Ne (Z=10): 1s2 2s22p6 |
→ Elektronska distribucija prijelaznih elemenata
Prijelazni elementi su raspoređeni između grupa 3 i 12 i imaju podrazine d to je f zauzet valentnim elektronima:
Vanjski prijelazni elementi: zadržati valentne elektrone u podrazini d, održavajući elektronsku konfiguraciju jednakom nas2 (n-1)d(1 do 8). Na primjer, element nikal (Z = 28) pripada skupini 10, a konfiguracija mu je 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Unutarnji prijelazni elementi: oni su dio grupe 3, ali su "unutarnji" periodnog sustava, prošireni su ispod njega, u periodima 6 (lantanidi) i 7 (aktinidi). Ovi elementi imaju valentne elektrone koji zauzimaju podljusku f i opću elektroničku konfiguraciju nas2 (n-2)f(1 do 13). Na primjer, element lantan (Z = 57) je prvi element u nizu lantanida, a njegova elektronska konfiguracija je 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Znajte također:Koje je podrijetlo periodnog sustava?
Riješene vježbe o obiteljima periodnog sustava
Pitanje 1
(UFC — prilagođeno) Što se tiče moderne periodične klasifikacije elemenata, označite točnu tvrdnju:
A) U periodnom sustavu, obitelji ili skupine odgovaraju vodoravnim crtama.
B) Elementi u obitelji imaju vrlo različita kemijska svojstva.
C) U obitelji elementi općenito imaju isti broj elektrona u posljednjoj ljusci.
D) U razdoblju elementi imaju slična kemijska svojstva.
E) Reprezentativni elementi raspoređeni su u skupine od 3 do 12.
rezolucija:
Alternativa C
Stavka A je netočna: obitelji ili grupe su stupci (okomite crte) periodnog sustava.
Stavke B i D netočne: U obitelji elementi imaju slična kemijska svojstva. U periodama, elementi imaju istu elektronsku ljusku koju zauzimaju valentni elektroni.
Stavka C točna: U obitelji elementi imaju isti broj elektrona u posljednjoj ljusci.
Točka E netočna: reprezentativni elementi su skupine 1, 2, 13, 14, 15, 16, 17 i 18. Prijelazni elementi raspoređeni su u skupine od 3 do 12.
pitanje 2
(EAM) Elementi A, B i C imaju sljedeće elektronske konfiguracije u svojim valentnim ljuskama:
O: 3s1
B: 4s2 4p4
C: 3s2
Na temelju ovih informacija odaberite ispravnu opciju.
A) Element A je alkalni metal.
B) Element B je halogen.
C) Element C je halkogen.
D) Elementi A i B pripadaju trećoj periodi periodnog sustava elemenata.
E) Tri elementa pripadaju istoj skupini periodnog sustava elemenata.
rezolucija:
Alternativa A
Zadatak A točan: element A ima elektroničku raspodjelu koja sadrži samo jedan valentni elektron, stoga pripada 1. skupini periodnog sustava elemenata.
Netočna stavka B: element B ima konfiguraciju elektrona 4s2 4p4, što ukazuje da postoji 6 elektrona u posljednjoj ljusci i da ovaj element pripada skupini 16 (halkogeni).
Netočna stavka C: element C ima elektroničku konfiguraciju s 2 elektrona u zadnjoj ljusci, pa je element 2. skupine u tablici.
Netočna stavka D: element A pripada trećoj periodi (n = 3), a element B pripada četvrtoj periodi (n = 4).
Netočna stavka E: tri elementa imaju različite količine elektrona u posljednjoj ljusci, tako da ne mogu biti dio iste obitelji.
Ana Luiza Lorenzen Lima
Profesor kemije
Izvor: Brazilska škola - https://brasilescola.uol.com.br/quimica/familias-da-tabela-periodica.htm