Alkoholi mogu biti podvrgnuti oksidaciji kada su izloženi oksidirajućem sredstvu, kao što je vodena otopina kalij-dikromata (K2Kr2O7) ili kalijev permanganat (KMnO4) u kiselom mediju.
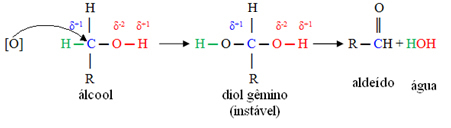
Novi kisik [O] u sredini će napasti ugljik povezan s funkcionalnom skupinom alkohola (hidroksil - OH), tvoreći vrlo nestabilan spoj, nazvan twin diol, koji ima dva hidroksila povezana s istim ugljik. Kako je nestabilan, ovaj spoj oslobađa vodu i stvara novi proizvod.
Ovaj proizvod ovisi o vrsti alkohola koji je oksidiran, bilo da je primarni, sekundarni, tercijarni ili metanol.
Ukratko, imamo:
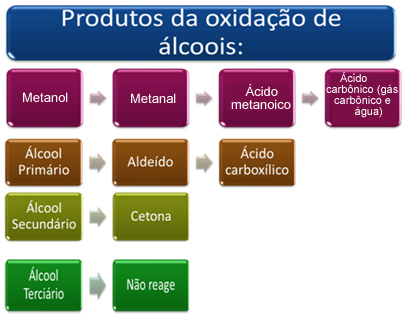
Pogledajte svaki slučaj u nastavku:
- Metanol (H3C─ OH):
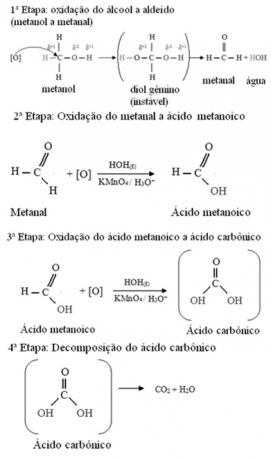
Metanol je jedini alkohol koji ima tri vodika vezana za ugljik koji će biti podvrgnut oksidaciji. U ovom slučaju, budući da postoje tri točke na molekuli koje kisik u nastajanju može napasti, dogodit će se tri uzastopne oksidacije, kao što je prikazano na donjem dijagramu:
- Primarni alkoholi:
U tim spojevima, hidroksilni ugljik je vezan samo za jedan atom ugljika, to jest, dva druga liganda su vodici, a postoje dva mjesta za napad kisika u nastajanju.
Prvo će doći do stvaranja aldehida, kao što je prikazano u nastavku:
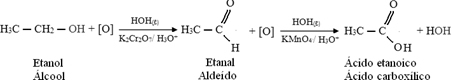
Ali, oksidacija se nastavlja, jer su reagensi koji se koriste za oksidaciju alkohola jači od onih koji se koriste za oksidaciju aldehida. Zatim, novi kisik u nastajanju napada karbonilni ugljik i proizvodi karboksilnu kiselinu.
Slijedi primjer, oksidacija etanola, prvo u etanal, a zatim u etansku kiselinu (octenu kiselinu). Ova ukupna reakcija je pretvorba vina u ocat.
Nemoj sada stati... Ima još toga nakon reklame ;)
Djelomična oksidacija etanola u etanal događa se kada osoba s alkoholom podvrgne testu alkotestom za jednokratnu upotrebu. Unutar ovog uređaja nalazi se čvrsta smjesa kalij-dikromata i silicijevog dioksida u kiselom mediju, sa sljedećom reakcijom:
K2Kr2O7 (aq) + 4H2SAMO4 (aq) + 3 CH3CH2Oh(g) → Kr2(SAMO4)3 (aq) + 7 ujutro2O(1) + 3 CH3CHO(g) + K2SAMO4 (aq)
narančaetanol (bezbojan)zelenaetanal (bezbojan)
Imajte na umu da, osim oksidacije etanola (alkohola) u etanal (aldehid), dolazi do istovremene redukcije dikromata, koji je narančasti, u krom (III) ili čak krom (II), koji je zelen. Promjena boje pokazat će da osoba ima više alkohola u krvi od dopuštenog.
- Sekundarni alkoholi:
To su spojevi u kojima je hidroksilni ugljik vezan za dva druga ugljikova atoma i samo jedan atom vodika. Stoga će postojati samo jedno mjesto u molekuli gdje kisik u nastajanju može napasti i formirat će se samo jedna vrsta proizvoda, koji će uvijek biti keton:
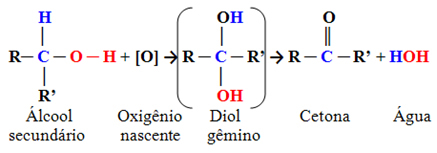
Budući da karbonilni ugljik ketona nema izravno vezan vodik na njega, više ne postoji mogućnost daljnje oksidacije. Stoga se reakcija zaustavlja na ketonu.
- tercijarni alkoholi:
Tercijarni alkoholi su oni u kojima ugljik koji ima -OH skupinu stvara tri veze s drugim atomima ugljika. Budući da se ne vežu s vodikom, nema točke na molekuli koju bi mogao napasti kisik u nastajanju. Zbog te činjenice tercijarni alkoholi ne podliježu oksidaciji.
* Izvor i autor slike: CostaPPPR.
Autora Jennifer Fogaça
Diplomirao kemiju
Želite li referencirati ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Oksidacija alkohola"; Brazilska škola. Dostupno u: https://brasilescola.uol.com.br/quimica/oxidacao-dos-alcoois.htm. Pristupljeno 27. srpnja 2021.
Kemija

Kako radi alkotest, koncentracija alkohola, alkotest, reakcije koje uključuju etil alkohol, vrste alkotest, kalijev dikromat, gorive ćelije, katalizator, otpuštanje elektrona, octena kiselina, vodik, konc

