Kako stoji u tekstu "Kemijska jednadžba“, za predstavljanje kemijskih reakcija i razumijevanje načina njihove obrade, njihovih kvantitativnih i kvalitativnih aspekata, dogovoreno je korištenje kemijskih jednadžbi. Kemijske jednadžbe sadrže simbole i brojeve koji pokazuju koje su tvari prisutne i odgovarajući omjer u kojem reagiraju.
Interpretacijom ovih jednadžbi moguće je pronaći važne podatke koji nam pomažu u izvođenju stehiometrijskih izračuna. Međutim, prvi korak kaže da jednadžba mora biti uravnotežena, odnosno da mora imati ukupan broj atoma reaktanata jednak broju proizvoda. Možete razumjeti kako izvesti ovo balansiranje kroz tekst "Balansiranje jednadžbe”.
Prije nego, međutim, shvatite neke važne koncepte u ovom slučaju, kao što je značenje pojmova: indeks, stehiometrijski koeficijent i mol. Ovi pojmovi će biti objašnjeni u nastavku i dati nam bolji uvid u kvantitativni dio reakcije:
- Indeks: je broj koji označava broj atoma svakog elementa prisutnog u kemijskim formulama. Ovaj broj dolazi s desne strane dotičnog elementa i pojavljuje se ispod indeksa, odnosno u manjoj veličini slova.
Primjer:
H2O (kemijska formula vodene tvari)
Što to znači:
- Elementi koji čine ovu tvar su H (vodik) i O (kisik).
- Indeks svakog elementa pokazuje koliko je atoma svakog od njih prisutno u formuli molekule vode:
H2O→ O-indeks: postoji samo 1 atom kisika.
↓
H indeks: označava da postoje 2 atoma vodika.
Imajte na umu da u slučaju kisika nema zapisanog broja, što znači da postoji samo 1 atom tog elementa, kao što je gore objašnjeno.
Sada, postoje neki slučajevi u kojima se zagrade pojavljuju u formulama. Kako bismo ovo trebali protumačiti? Pogledajte primjer u nastavku:
Ovdje3(PRAH4)2(kemijska formula tvari kalcijevog fosfata)
- Sadržaj Ca pokazuje da su u kemijskoj formuli prisutna 3 atoma elementa kalcija;
- P (fosfor) i O (kisik) su u zagradama, pa indeks koji je izvan, koji je u ovom slučaju 2, pripada oba. Dakle, da biste saznali koliko atoma svakog ima u formuli, morate pomnožiti njihove indekse zasebno s vanjskim indeksom. Obratite pažnju kako se to radi:

Nemoj sada stati... Ima još toga nakon reklame ;)
P → indeks 1 O → indeks 4
P = 1. 2 O = 4. 2
P = 2 O = 8
Dakle, postoje 2 atoma fosfora i 8 atoma kisika.
- Stehiometrijski koeficijent: je broj koji dolazi ispred formule i označava količinu svake tvari i udio molekula koje sudjeluju u reakciji. Dakle, kao i u slučaju indeksa, kada je koeficijent jednak 1, nije ga potrebno zapisivati, kao što se podrazumijeva.
Primjer:
2H2 + 1O2 → 2 H2O (ova reakcija stvaranja vode prikazana je na uvodnoj slici)
↓ ↓ ↓
Reakcijski koeficijenti
U ovoj je jednadžbi, kroz koeficijente, prikazano da dvije molekule plinovitog vodika reagiraju s jednom molekule plina kisika, te nastaju dvije molekule vode kao produkt. Dakle, stehiometrijski omjer ove reakcije je 2:1:2.
Da biste saznali ukupan broj atoma svakog elementa koji su prisutni u reakciji, potrebno je pomnožiti koeficijente s indeksima svakog elementa:
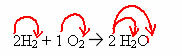
reagensi:
H = 2. 2 = 4 atoma vodika
O = 1. 2 = 2 atoma kisika
Proizvod:
H = 2. 2 = 4 atoma vodika
O = 1. 2 = 2 atoma kisika
Imajte na umu da ste dali istu količinu reaktantima i produktima, što znači da je reakcija pravilno uravnotežena.
- Mol (količina tvari):u kemijskoj jednadžbi smatra se da koeficijenti označavaju količinu mola ili količinu tvari. Dakle, u prethodnom slučaju imamo 2 mola H2 reagira s 1 molom O2, stvarajući kao produkte 2 mola H2O.
Autora Jennifer Fogaça
Diplomirao kemiju
Želite li referencirati ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Kvantitativni pojmovi u kemijskoj jednadžbi"; Brazilska škola. Dostupno u: https://brasilescola.uol.com.br/quimica/termos-quantitativos-uma-equacao-quimica.htm. Pristupljeno 27. srpnja 2021.