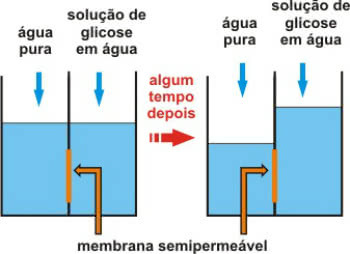
Prilikom pripreme otopine, to jest, prilikom otapanja otopljene tvari u danom otapalu, molekule ili ioni otopljene tvari se odvajaju, ostajući dispergirani u otapalu.
Možemo uspostaviti odnos između različitih otopljenih tvari i karakteristika njihovih vodenih otopina kroz vrlo jednostavne pokuse provedene na istoj temperaturi. Obratite pažnju na sljedeće situacije:
THE)
B)
Dok gledamo rješenja THE i B, primijetili smo da je sol manje topiva od šećera i na temelju te činjenice možemo generalizirati:
Zasićena otopina: je onaj koji sadrži maksimalnu količinu otopljene tvari u danoj količini otapala, na danoj temperaturi; odnos između najveće količine otopljene tvari i količine otapala naziva se koeficijent topljivosti. Primjer: Maksimalna količina soli (NaCl) koja se otapa u 100 g H2Na 20°C iznosi 36 g; otopina se naziva zasićena.
Otopina s količinom otopljene tvari manjom od koeficijenta topljivosti naziva se otopinom. nezasićen ili nezasićen.
Nemoj sada stati... Ima još toga nakon reklame ;)
Rješenja - Fizikalno-kemijski
Kemija - Brazilska škola
Želite li referencirati ovaj tekst u školskom ili akademskom radu? Izgled:
ŠKOLA, tim Brazila. "Krivulje topljivosti i topljivosti"; Brazilska škola. Dostupno u: https://brasilescola.uol.com.br/quimica/solubilidade-curvas-solubilidade.htm. Pristupljeno 27. srpnja 2021.