THE entalpija je termodinamička funkcija kojom izračunava toplinu uključenu u izobarne procese, odnosno koji se drže pod stalnim pritiskom. Njegov se razvoj dogodio nedugo nakon pada kalorijske teorije, s napretkom termodinamika između 1840. i 1850. godine.
Entalpija, za štoumica, nema puno značenja ako se radi kao apsolutna i izolirana vrijednost, ali ima kada se uzme u obzir varijacija njegove vrijednosti u kemijskom procesu. Postoji nekoliko načina za izračunavanje varijacije entalpije procesa, a glavni su putem energije formiranja, vezivanja i također putem tamohej od hessa.
Pročitaj i: Što je Gibbs Free Energy?
Entalpijski sažetak
Entalpija je termodinamički alat za izračunavanje topline uključene u procese koji se odvijaju pri konstantnom tlaku.
Definirao ga je američki fizičar Josiah W. Gibbsa, u kontekstu pada kalorijske teorije.
U kemiji uvijek koristimo promjenu entalpije, predstavljenu kao ΔH.
Kemijske reakcije koje apsorbiraju toplinu nazivaju se endotermne i imaju ΔH > 0.
Kemijske reakcije koje oslobađaju toplinu nazivaju se egzotermnim i imaju ΔH < 0.
Video lekcija o entalpiji
Što je entalpija?
U početku je entalpija, uvijek predstavljena s H definirao američki fizičar Josiah Willard Gibbs, koju je nazvao funkcijom topline pri konstantnom tlaku, budući da, njegovim riječima:
“[…] smanjenje funkcije predstavlja, u svim slučajevima kada tlak ne varira, toplinu koju sustav daje.”
Iz Gibbsova rada, dakle, možemo razumjeti entalpiju kao termodinamičku funkciju čija varijacija je brojčano jednaka količini topline razmijenjene u sustavu, do pritisak konstantno. To znači da, u izobarnim procesima (kao i većina kemijskih procesa), znanje izračunati varijaciju funkcije entalpije, tada se može znati vrijednost razmijenjene topline između sustava i susjedstvo.

Takva korelacija s toplinom uzrokuje mnogi učenici pogrešno misle da je entalpija sinonim za toplina ili nešto poput energetskog sadržaja, toplinskog sadržaja, oslobođene topline i apsorbirane topline i slično.
Entalpija je nastala u kontekstu kolapsa kalorijske teorije, koja je toplinu tretirala kao nemjerljivu materijalnu tvar koja se prenosila s toplijih tijela na hladnija tijela. Stoga se pojavila potreba za novim alatom za izračun topline. Rješenje je, dakle, bilo korištenje veličina koje su već imale definirane termodinamičke jednadžbe, kao što je entalpija.
Pročitaj i: Kako izračunati promjenu entalpije otopine?
varijacija entalpije
Budući da je entalpija alat koji se koristi za izračunavanje topline razmijenjene u kemijskom procesu, nema smisla koristiti je kao apsolutni, izolirani broj, ali s obzirom na njegovu varijaciju, odnosno u praksi, trebali bismo samo procijeniti koliko se, brojčano, entalpija promijenila tijekom kemijskog procesa, budući da nas termodinamika uvjerava da je njena varijacija je brojčano jednak toplini koja se oslobađa ili apsorbira u procesu.
Strogo govoreći, varijaciju entalpije možemo definirati kao:
ΔH = HZavršno - Hpočetni
Kao iu kemijskim procesima, završni korak se može smatrati proizvodima, a početni korak se može smatrati reagensima. Također je uobičajeno vidjeti definiciju varijacije entalpije kao:
ΔH = Hproizvodi - Hreagensi
S praktične i interpretativne točke gledišta, ako je promjena entalpije pozitivna (ΔH> 0), kažemo da je kemijska reakcija endotermički, odnosno postoji apsorpcija topline tijekom cijelog procesa. Već ako je promjena entalpije negativna (ΔH< 0), kažemo da je kemijska reakcija egzotermna, odnosno toplina se oslobađa tijekom cijelog procesa.
Varijacija entalpije se u mnogim slučajevima promatra na grafikonima, kao što je prikazano u sljedećim primjerima.
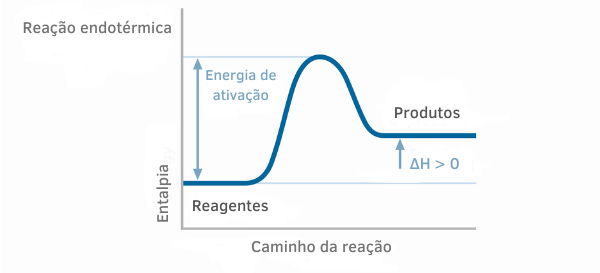
Primjer 1:
Tablica endotermne reakcije
Na grafikonima entalpije za endotermne reakcije može se vidjeti da je količina entalpije produkata veća od entalpije reaktanata, što ukazuje da je varijacija duž reakcije pozitivna. Dakle, ako je ΔH > 0, možemo reći da se kemijski proces odvijao uz apsorpciju topline.
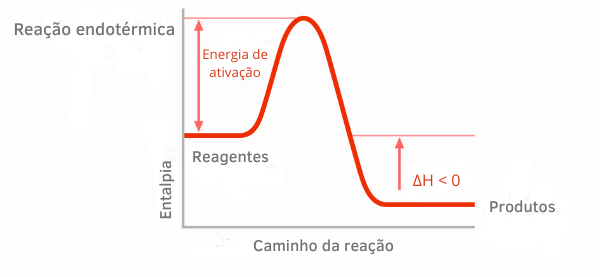
Primjer 2:
Tablica egzotermnih reakcija:
Na grafikonima entalpije za egzotermne reakcije može se vidjeti da je količina entalpije produkata manja od one reaktanata, što ukazuje da je varijacija duž reakcije negativna. Dakle, budući da je ΔH < 0, možemo reći da se kemijski proces dogodio oslobađanjem topline.
Više o ovim klasifikacijama kemijskih reakcija pročitajte u tekstu: ZAendotermni i egzotermni procesi.
Vrste entalpije
entalpija formiranja
THE entalpija formiranja é izračunati bazirano na kemijske reakcije stvaranja, koje su reakcije u kojima na sobnoj temperaturi i 1 atmosferi tlaka nastaje jedan mol složenih tvari iz njihovih najstabilnijih jednostavnih tvari.
H2(g) + ½ O2 (g) → H2O (l) H°f = -286 kJ/mol
Velika prednost entalpije nastajanja je da jednostavne tvari koje su stabilnije na sobnoj temperaturi i 1 atmosferi tlaka imaju entalpiju dogovorenu na nulu. To ne znači da su zapravo nula, ali se, radi pojednostavljenja i bolje klasifikacije, tretiraju ovako.
Biće H = Hproizvodi - Hreagensi, ako uzmemo u obzir, onda, da je Hreagensi = 0, možemo reći da se promatrana vrijednost ΔH odnosi samo na produkte, koji su u tim slučajevima uvijek jedan mol spojene tvari. Stoga ovu vrijednost prikazujemo kao standardnu varijaciju entalpije formiranja vode, predstavljenu s ΔH°f.
S ovom metodologijom nekoliko je tvari imalo svoje varijacije standardna entalpija formacijske tablice, kao što možemo vidjeti u nastavku.
tvar |
Entalpija formiranja (ΔH°f) u kJ/mol |
CO2 (g) |
-393,4 |
CaO(s) |
-634,9 |
HI (g) |
+25,9 |
NE (g) |
+90,1 |
entalpija vezanja
Entalpija vezanja služi za označavanje količine energije uključene u rupturu ili stvaranje danog madeža. kemijska veza.
Podrazumijeva se da, za prekid kemijske veze potrebno je apsorbirati toplinu, tako da vezni atomi povećavaju svoje unutarnja energija i, posljedično, povećati svoju kinetičku energiju. s većim kinetička energija, atomi vibriraju intenzivnije, uzrokujući kidanje veza. Dakle, svaki prekid veze je endotermni proces.
Inače, da bi formirali kemijsku vezu, atomi gube slobodu kretanja i moraju smanjiti stupanj kretanja, smanjujući svoju kinetičku energiju. Tada se rezervna energija oslobađa u obliku topline. Tako, svo stvaranje veza je egzotermni proces.
Donja tablica prikazuje vrijednosti energija povezanih sa svakom kemijskom vezom.
Povezivanje |
Energija vezanja (kJ/mol) |
CH |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
NE |
943,8 |
Imajte na umu da u vrijednostima nema znakova, jer su u modulu. To je zato što signal morate dodijeliti vi ovisno o tome je li veza prekinuta ili formirana.
Entalpija izgaranja
THE entalpija izgaranja služi za označavanje količina topline koja se oslobađa pri izgaranju jednog mola tvari. Treba napomenuti da je svaka reakcija izgaranja egzotermna, jer svako gorenje oslobađa toplinu.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2ΔH°Ç = -889,5 kJ/mol
Donja tablica prikazuje vrijednosti entalpije izgaranja za neke kemijske tvari.
tvar |
Entalpija izgaranja (ΔH°Ç) u kJ/mol |
Etanol - C2H5OH (1) |
-1368 |
Benzen - C6H6 (1) |
-3268 |
Oktan - C8H18 (1) |
-5471 |
Glukoza - C6H12O6 (s) |
-2808 |
Entalpija promjene fizičkog stanja
Svaka promjena fizičkog stanja uključuje izmjenu topline. Stoga, entalpija promjene fizičkog stanja služi za označavanje količina topline uključena u procese promjene fizičkog stanja.
Na primjer, imamo isparavanje vode:
H2O (1) → H2O (g) ΔH = +44 kJ/mol
Pri topljenju vode imamo:
H2O(s) → H2O (l) ΔH = +7,3 kJ/mol
Vrijednosti entalpije su simetrične za inverzne procese, što znači da je npr. promjena entalpije u ukapljivanju vode -44 kJ/mol, dok je pri njenom skrućivanju jednaka -7,3 kJ/mol.
Pročitaj i: Što je entropija?
Riješene vježbe o entalpiji
Pitanje 1 - (UERJ 2018) Kapacitet zagađivanja ugljikovodika koji se koristi kao gorivo određen je omjerom između oslobođene energije i količine CO2 nastala u svom potpunom izgaranju. Što je veći omjer, to je manji kapacitet zagađivanja. Donja tablica prikazuje standardnu entalpiju izgaranja četiri ugljikovodika.

Iz tablice, ugljikovodik s najmanjim zagađujućim kapacitetom je:
Oktan
heksan
Benzen
pentan
Rezolucija
Alternativa D
Pitanje pokazuje da je kapacitet zagađivanja definiran kao omjer (kvocijent) između oslobođene energije i količine CO2 nastala u svom potpunom izgaranju. Što je veća razlog, što je kapacitet zagađivanja manji, odnosno oslobađa se više energije po molu CO2 generirana.
Reakcije potpunog izgaranja Ugljikovodici citirani su:
Oktan: Ç8H18 +25/2 O2 → 8 CO2 + 9 sati2Razlog: 5440/8 = 680
heksan: Ç6H14 +19/2 O2 → 6 CO2 + 7 sati2Razlog: 4140/6 = 690
Benzen: Ç6H6 + 15/2 O2 → 6 CO2 + 3 H2Razlog: 3270/6 = 545
pentan: Ç5H12 + 8 O2 → 5 CO2 + 6 H2Razlog: 3510/5 = 702
Dakle, možemo zaključiti da je pentan ugljikovodik s najmanjim zagađujućim kapacitetom.
Pitanje 2 - (Enem 2015.) Korištenje šumskih ostataka svakim je danom sve atraktivnije, jer su obnovljivi izvor energije. Slika predstavlja izgaranje bio-ulja izvađenog iz drvnog otpada, gdje je ΔH1 varijacija entalpije zbog sagorijevanja 1 g ovog bio-ulja, što rezultira ugljičnim dioksidom i tekućom vodom, i ΔH2 promjena entalpije uključena u pretvorbu 1 g vode u plinovitom stanju u tekuće stanje.

Varijacija entalpije, u kJ, za sagorijevanje 5 g ovog bioulja, što rezultira CO2 (plinoviti) i H2(plinoviti) je:
A) -106
B) -94
C) -82
D) -21.2
E) -16,4
Rezolucija
Alternativa C
Iz prikazanog grafikona imamo ΔH1 kao varijacija entalpije izgaranja bio-ulja pri čemu se proizvodi CO2 (g) i H2O (1) i ΔH2 kao promjena entalpije ukapljivanja vode, budući da CO2 ostaje plinovito i samo fizičko stanje Voda promjene (iz plina u tekućinu).
Vježba zahtijeva promjenu entalpije sagorijevanja 5 g bio-ulja, što rezultira CO2 (plinoviti) i H2O (plinoviti). Iz dijagrama se ova promjena entalpije može definirati kao ΔH = ΔH1 – H2. Dakle, vrijednost ΔH bit će jednaka -16,4 kJ/g. Ova varijacija, kao što možemo vidjeti u jedinici, je za SVAKI gram bio-ulja. Za 5 grama, moramo učiniti proporcija:
1 g bio-ulja -16,4 kJ
5 g bio-ulja x
1. x = 5. (-16,4)
x = -82 kJ
Tada možemo označiti alternativu C.
Autor: Stéfano Araújo Novais
Nastavnica kemije


