Organska kemija široko je područje kemije koje proučava ugljikove spojeve.
Znanju iz organske kemije pristupa se na nekoliko načina i, razmišljajući o tome, sastavili smo vam predložene vježbe, prijemne ispite i Enem pitanja kako bismo provjerili svoje znanje.
Također upotrijebite komentare rezolucija da biste saznali još više o toj temi.
Predložene vježbe
Pitanje 1
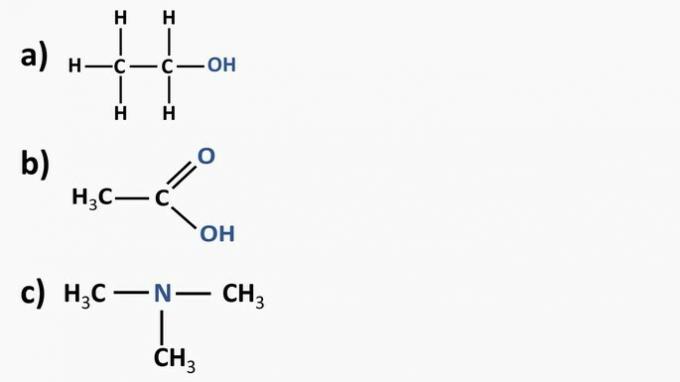
Pogledajte organske spojeve u nastavku i identificirajte organske funkcije prema istaknutim funkcionalnim skupinama. Nakon toga imenujte tvari.
Odgovor:
a) Organski spoj: etanol
- organska funkcija: alkohol
- Opća formula: R — OH
- Identifikacija: hidroksil (OH) povezan s ugljikovim lancem
b) Organski spoj: etanska kiselina.
- Organska funkcija: karboksilna kiselina
- Opća formula: R — COOH
- Identifikacija: karboksilni radikal (COOH) povezan s ugljikovim lancem
c) Organski spoj: trimetilamin
- Organska funkcija: amin (tercijar)
- Opća formula:
- Identifikacija: dušik povezan s tri ugljikova lanca
pitanje 2
U organskoj kemiji spojeve prepoznaju lanci nastali ugljikom i vodikom. Međutim, drugi elementi mogu biti dio kemijske strukture ovih spojeva, poput kisika.
Odaberite alternativu u kojoj dva organska spoja imaju oksigenirane organske funkcije.
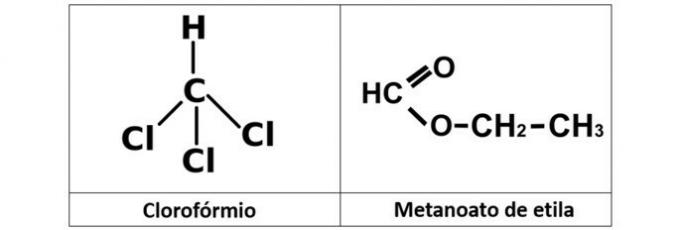
a) kloroform i etil metaneat
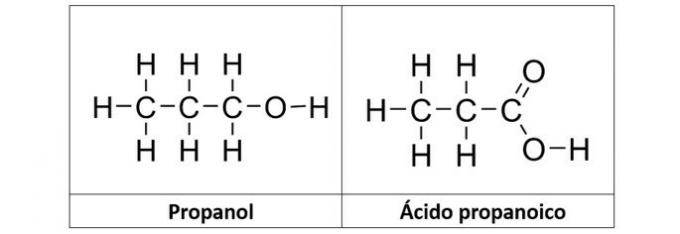
b) propanol i propanska kiselina
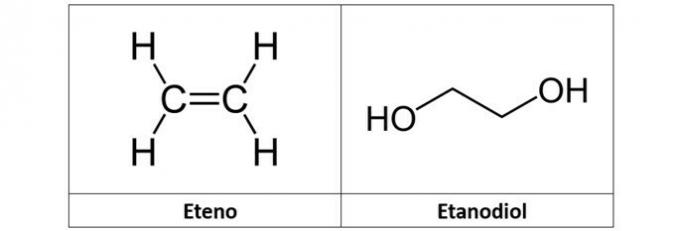
c) eten i etandiol
d) etanamid i benzen
Točan odgovor: b) propanol i propanska kiselina
a) POGREŠNO. Imamo kloroform (CHCl3), koji je alkil halogenid, i ester etil metanoata (C3H6O2), koji u svojoj strukturi sadrži kisik.
b) TOČNO. U ovoj alternativi imamo dva spoja koji imaju kisikove organske funkcije. Propanol (C3H8O) je alkohol koji tvore tri ugljika. Propanska kiselina (C3H6O2) je karboksilna kiselina.
c) POGREŠNO. Etilen (C2H4), koji se također naziva etilen, je ugljikovodik alkenskog tipa. Već etandiol (C2H6O2) je alkohol s dva hidroksila u svojoj strukturi.
d) POGREŠNO. Etanamid (C2H5NO) je amid, a benzen je aromatski ugljikovodik i stoga nastaje samo od ugljika i vodika.

pitanje 3
Pogledajte strukturu organskog spoja u nastavku i provjerite istinite tvrdnje.

(01) Spoj ima organsku dušikovu funkciju.
(02) Primarni je amin, jer je vezan samo za jedan vodik.
(03) Naziv spoja je dietilamin.
Točan odgovor:
(01) TOČNO. Funkcija organskog dušika prisutna u spoju je amin.
(02) POGREŠNO. Sekundarni je amin, jer je dušik povezan s dva ugljikova lanca.
(03) POGREŠNO. Ime spoja je dimetilamin, jer su dva metilna radikala vezana za dušik.
pitanje 4
Eugenol, član obitelji fenilpropanoida, aromatični je organski spoj prisutan u klinčićima, začinu koji se koristio od davnina.

Promatrajte strukturnu formulu spoja i prepoznajte prisutne organske funkcije.
a) Alkohol i eter
b) Fenol i eter
c) Alkohol i ester
d) Fenol i ester
e) Alkohol i ugljikovodik
Ispravna alternativa: b) Fenol i eter.
Eugenol u svom lancu ima oksigenirane organske funkcije, odnosno, osim atoma ugljika i vodika, i kisik je prisutan heteroatom.
Organsku funkciju fenola karakterizira hidroksil (-OH) vezan za aromatski prsten. U funkciji etera, kisik se nalazi između dva ugljikova lanca.
5. pitanje
EDTA, čiji je puni naziv etilendiamintetraoctena kiselina, organski je spoj s mnogim primjenama. Njegova sposobnost vezanja metalnih iona čini ga helatnim agensom koji se široko koristi u laboratoriju i industrijski.
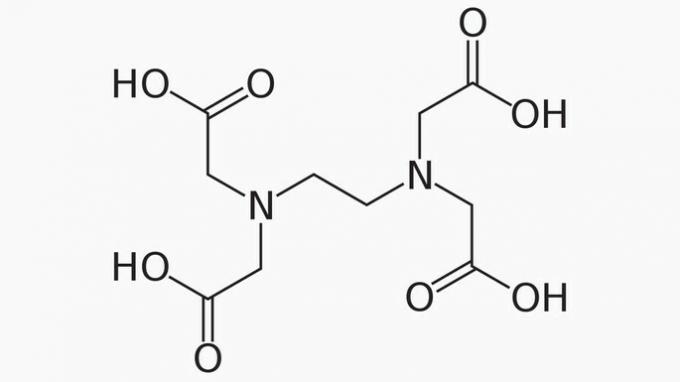
Što se tiče EDTA-e, ispravno je reći da je lanac ugljika:
a) Otvoreni, homogeni i nezasićeni.
b) Zatvoreno, heterogeno i zasićeno.
c) Otvoreni, heterogeni i nezasićeni.
d) Zatvoreno, homogeno i zasićeno.
e) Otvoreni, heterogeni i zasićeni.
Točan odgovor: e) Otvoreni, heterogeni i zasićeni.
Lanac EDTA klasificiran je na:
OTVORENA. Prema rasporedu atoma ugljika u strukturi EDTA, možemo vidjeti da se, zbog prisutnosti krajeva, lanac spoja otvara.
HETEROGENI. Osim ugljikovih i vodikovih spojeva, ugljikov lanac ima heteroatome dušika i kisika.
ZASICENO. Veze između atoma ugljika su zasićene, jer lanac ima samo jednostruke veze.
Saznajte više na: Organska kemija.
pitanja prijemnog ispita
Pitanje 1
(UFSC) Promatrajte nepotpune organske strukture i identificirajte ispravne predmete:
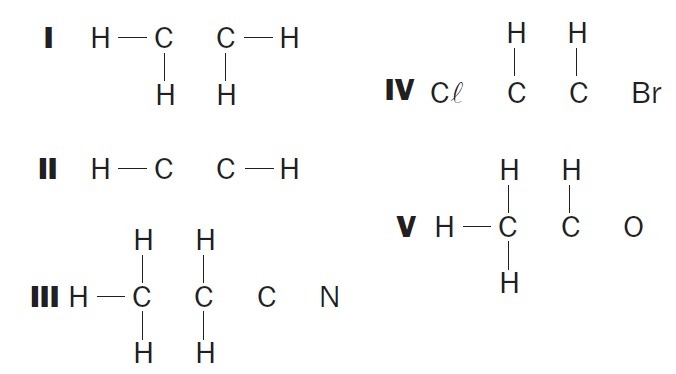
(01) Strukturi I nedostaje jednostruka veza između atoma ugljika.
(02) Strukturi II nedostaje trostruka veza između atoma ugljika.
(03) Strukturi III nedostaju dvije jednostruke veze između atoma ugljika i trostruka između atoma ugljika i dušika.
(04) Strukturi IV nedostaju dvije jednostruke veze između atoma ugljika i halogena i dvostruka veza između atoma ugljika.
(05) U strukturi V nedostaje jednostruka veza između atoma ugljika i jednostruka veza između atoma ugljika i kisika.
Ispravne alternative: 02, 03 i 04.
Osim ugljika, obveznog kemijskog elementa u organskim spojevima, i drugi elementi mogu biti prisutni u strukturama i povezani kovalentnim vezama, gdje se dijele elektroni.
Valencija elemenata određuje broj veza koje se mogu stvoriti, kao što je prikazano u donjoj tablici.
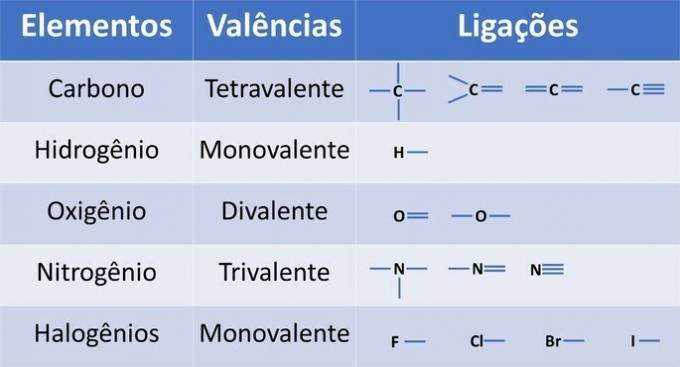
Iz ovih podataka imamo:
(01) POGREŠNO. Strukturi nedostaje dvostruka veza između atoma ugljika da bi se dobio etenski spoj.
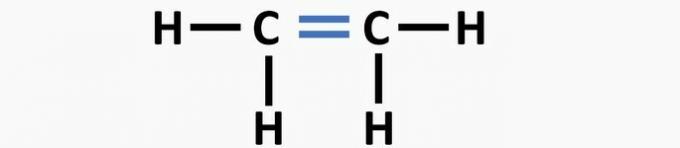
(02) TOČNO. Strukturi nedostaje trostruka veza između atoma ugljika da bi se stvorio etinski spoj.
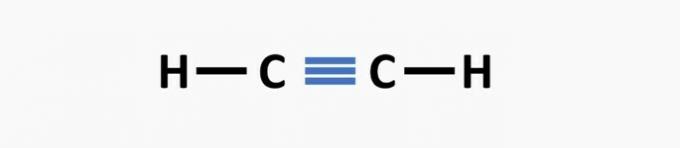
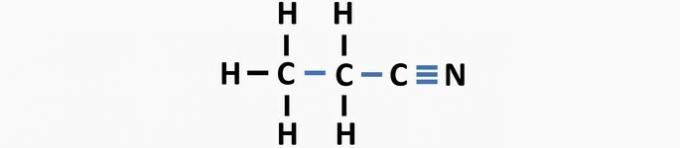
(03) TOČNO. U strukturi nedostaju jednostruke veze između ugljika i trostruke veze između ugljika i dušika kako bi nastao spoj propanenitril.
(04) TOČNO. U strukturi nedostaju jednostruke veze između ugljika i halogena, te dvostruke veze između ugljika kako bi se dobio diklortenski spoj.
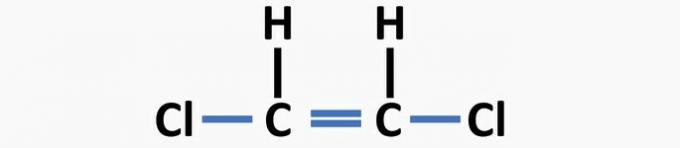
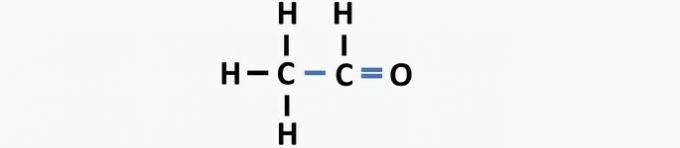
(05) POGREŠNO. Strukturi nedostaje jednostruka veza između ugljika i dvostruka veza između ugljika i kisika kako bi se dobio etanski spoj.
pitanje 2
(UFPB) Struktura organskog spoja molekulske formule C5H8Ono što predstavlja razgranati, nezasićeni, heterogeni i aliciklični lanac je:

Ispravna alternativa: d.
Ugljični lanci mogu se klasificirati na sljedeći način:
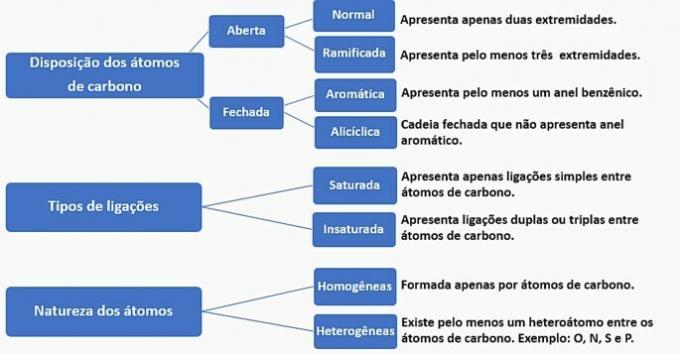
Prema tim informacijama imamo:
a) POGREŠNO. Lanac je klasificiran kao normalan, zasićen, homogen i alicikličan.
b) POGREŠNO. Lanac je klasificiran kao normalan, nezasićen, homogen i otvoren.
c) POGREŠNO. Lanac je klasificiran kao razgranat, nezasićen, homogen i otvoren.
d) TOČNO. Lanac je klasificiran kao razgranat, nezasićen, heterogen i alicikličan
- Ima granu: metilni radikal;
- Ima nezasićenje: dvostruka veza između ugljika;
- Ima heteroatom: kisik vezan za dva ugljika;
- Predstavlja zatvoreni lanac: ugljikovi povezani u krug bez prisutnosti aromatičnog prstena.
e) POGREŠNO. Lanac je klasificiran kao razgranat, nezasićen, heterogen i otvoren.
pitanje 3
(Centec-BA) U dolje prikazanoj strukturi brojevi ugljika su:
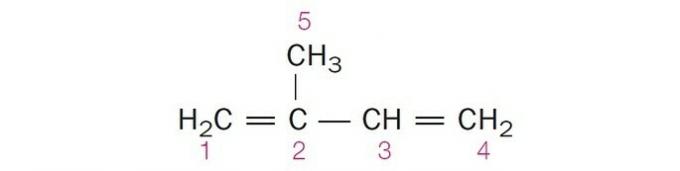
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Ispravna alternativa: c) sp2, sp2, sp2, sp2, sp3.
Budući da ima 4 elektrona u valentnoj ljusci, ugljik je četverovalentan, odnosno ima tendenciju stvaranja 4 kovalentne veze. Te obveznice mogu biti jednostruke, dvostruke ili trostruke.
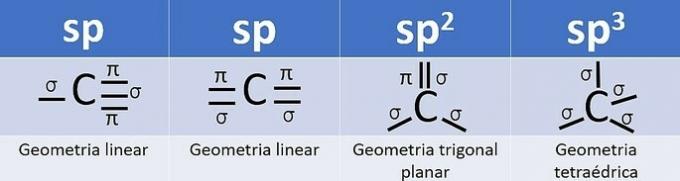
Broj hibridnih orbitala zbroj je sigma veza (σ) ugljika, budući da veza ne hibridizira.
- sp: 2 sigma veze
- sp2: 3 sigma veze
- sp3: 4 sigma veze
Prema tim informacijama imamo:
a) POGREŠNO. Ugljik 2 ima sp hibridizaciju2, jer ima 3 σ veze i jednu vezu .
b) POGREŠNO. Ugljik nema sp hibridizaciju4 a sp hibridizacija se događa kada između ugljika postoji trostruka veza ili dvije dvostruke veze.
c) TOČNO. Zbroj σ veza na svakom ugljiku daje alternativnu hibridizaciju.
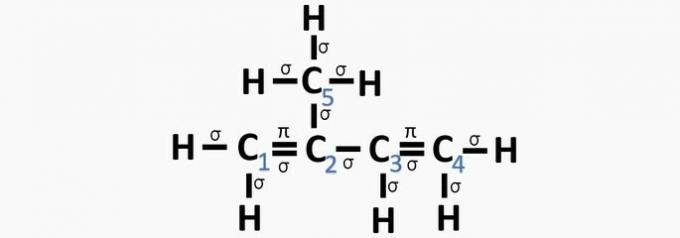
d) POGREŠNO. Sp hibridizacija se događa kada između ugljika postoji trostruka veza ili dvije dvostruke veze.
e) POGREŠNO. Ugljik nema sp hibridizaciju4 a sp hibridizacija se događa kada između ugljika postoji trostruka veza ili dvije dvostruke veze.
pitanje 4
(UFF) Postoji plinoviti uzorak koji tvori jedan od sljedećih spojeva: CH4; Ç2H4; Ç2H6; Ç3H6 ili C3H8. Ako 22 g ovog uzorka zauzima volumen od 24,6 L pod tlakom od 0,5 atm i temperaturom od 27 ° C (dato: R = 0,082 L .atm. K–1.mol–1), zaključeno je da je riječ o plinu:
a) etan.
b) metan.
c) propan.
d) propen.
e) eten.
Ispravna alternativa: c) propan.
1. korak: pretvorite temperaturnu jedinicu iz Celzija u Kelvine.
2. korak: izračunajte broj molova spoja pomoću opće jednadžbe plina.
3. korak: izračunajte molarnu masu spoja.
4. korak: pronađite ugljikovodik koji ima molarnu masu 44 g / mol.
Metan
Ethene
Etan
propilen
Propan
Stoga se zaključuje da je plin koji odgovara informacijama u izjavi propan.
5. pitanje
(ITA) Uzmite u obzir sljedeće tvari:
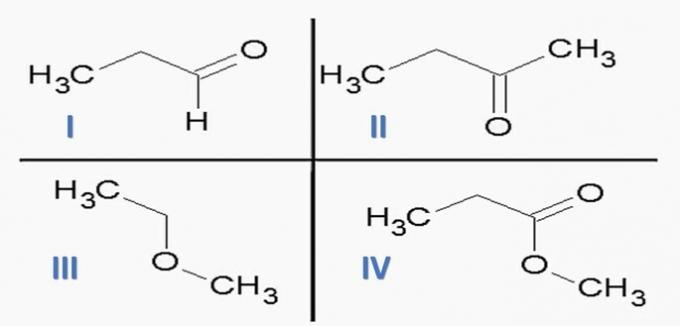
i sljedeće kemijske funkcije:
The. karboksilna kiselina;
B. alkohol;
ç. aldehid;
d. keton;
i. ester;
f. eter.
Opcija koja PRAVILNO povezuje tvari s kemijskim funkcijama je:
a) Id; IIc; IIIe; IVf.
b) Ic; IId; IIIe; PDV
c) Ic; IId; IIIf; IVe.
d) Id; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
Ispravna alternativa: c) Ic; IId; IIIf; IVe.
Organske funkcije određuju strukture i grupiraju organske spojeve sa sličnim karakteristikama.
Kemijske funkcije prisutne u alternativama su:
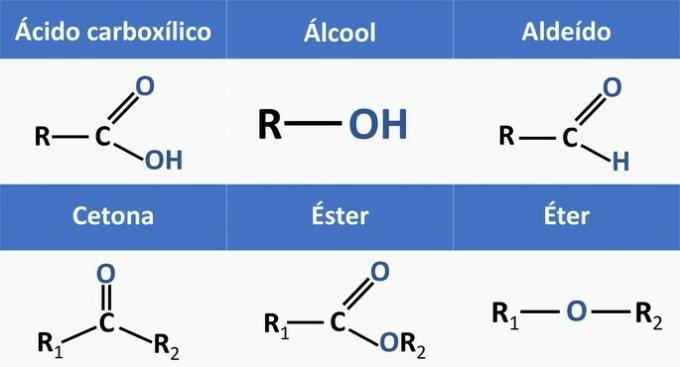
Analizirajući gornje strukture i spojeve prisutne u izjavi, imamo:
a) POGREŠNO. Funkcije organa su točne, ali slijed je pogrešan.
b) POGREŠNO. Među spojevima nema karboksilne kiseline.
c) TOČNO. Funkcionalne skupine prisutne u spojevima predstavljaju sljedeće kemijske funkcije.

d) POGREŠNO. I je aldehid, a II je keton.
e) POGREŠNO. Među spojevima nema karboksilne kiseline.
Saznajte više na: Organske funkcije.
Pitanja o neprijateljima
Pitanje 1
(Enem / 2014) Jedna metoda za određivanje sadržaja etanola u benzinu sastoji se od miješanja poznatih količina vode i benzina u određenoj boci. Nakon mućkanja tikvice i čekanja određenog vremenskog razdoblja, mjere se količine dvije dobivene faze koje se ne mogu miješati: jedne organske i druge vodene. Etanol, koji se nekada miješao s benzinom, sada se miješa s vodom.
Da bismo objasnili ponašanje etanola prije i nakon dodavanja vode, potrebno je znati
a) gustoća tekućina.
b) veličina molekula.
c) tačka ključanja tekućina.
d) atomi prisutni u molekulama.
e) vrsta interakcije između molekula.
Točna alternativa: e) vrsta interakcije između molekula.
Intermolekularne sile utječu na topljivost organskih spojeva. Tvari se teže otapati jedna s drugom kad imaju istu intermolekularnu silu.
Pogledajte u tablici dolje neke primjere organskih funkcija i vrstu interakcije između molekula.
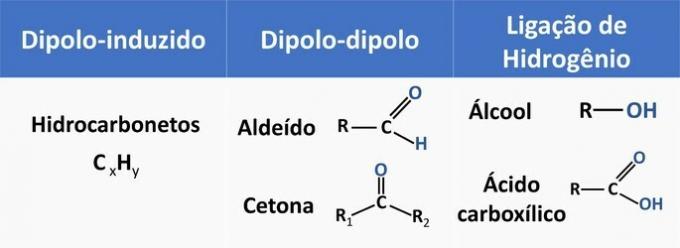
Etanol se smatra polarnim otapalom, jer u svojoj strukturi ima polarnu skupinu (-OH). Međutim, njegov ugljikov lanac, budući da je nepolaran (CH), može komunicirati s nepolarnim otapalima. Stoga se etanol otapa i u vodi i u benzinu.
Prema tim informacijama imamo:
a) POGREŠNO. Gustoća odnosi masu tijela na zauzeti volumen.
b) POGREŠNO. Veličina molekula utječe na polarnost spojeva: što je veći ugljikov lanac, tvar postaje nepolarnija.
c) POGREŠNO. Vrelište je korisno za odvajanje molekula: destilacija razdvaja spojeve s različitim vrelištima. Što je niže vrelište, molekula se lakše isparava.
d) POGREŠNO. Aldehid u svojoj strukturi ima ugljik, vodik i kisik. Ovaj spoj vrši dipol-dipol interakcije, dok alkohol, koji ima iste elemente, sposoban je stvoriti vodikove veze.
e) TOČNO. Interakcija etanola s vodom (vodikova veza) intenzivnija je nego s benzinom (diplo-inducirano).
pitanje 2
(Enem / 2013) Molekule nanoputani oni nalikuju ljudskim figurama i stvoreni su da potaknu interes mladih za razumijevanje jezika izraženog u strukturnim formulama, široko korištenim u organskoj kemiji. Primjer je NanoKid, predstavljen na slici:
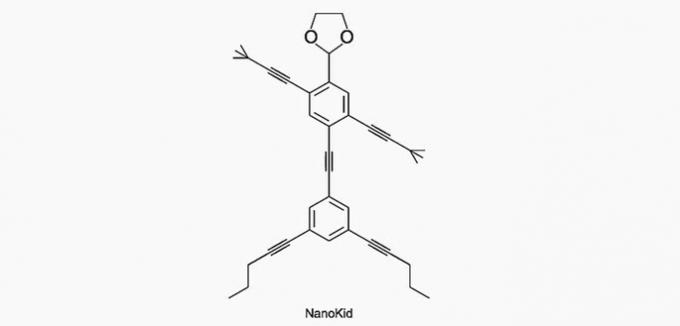
Gdje se u tijelu NanoKida nalazi kvaterni ugljik?
a) Ruke.
b) Glava.
c) Prsa.
d) Trbuh.
e) Stopala.
Ispravna alternativa: a) Ruke.
Ugljik se klasificira na sljedeći način:
- Primarno: veže se na ugljik;
- Sekundarno: veže se na dva ugljika;
- Tercijar: veže se na tri ugljika;
- Kvartar: veže se na četiri ugljika.
Pogledajte primjere u nastavku.

Prema tim informacijama imamo:
a) TOČNO. Ugljik u ruci vezan je za četiri druga ugljika, tako da je kvaterni.
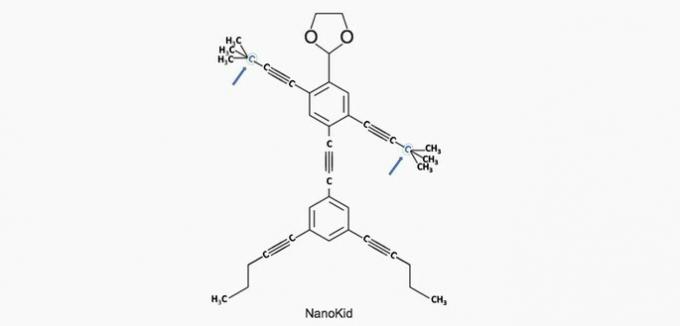
b) POGREŠNO. Glava se sastoji od primarnih ugljika.
c) POGREŠNO. Sanduk se sastoji od sekundarnih i tercijarnih ugljika.
d) POGREŠNO. Trbuh se sastoji od sekundarnih ugljika.
e) POGREŠNO. Stopala se sastoje od primarnih ugljika.
pitanje 3
(Enem / 2014) Neki polimerni materijali ne mogu se koristiti za proizvodnju određenih vrsta artefakata, niti za ograničenja mehaničkih svojstava, bilo lakoćom s kojom prolaze kroz razgradnju, stvarajući za to nepoželjne nusproizvode primjena. Stoga inspekcija postaje važna kako bi se utvrdila priroda polimera koji se koristi u proizvodnji artefakta. Jedna od mogućih metoda temelji se na razgradnji polimera kako bi se dobili monomeri koji su ga doveli.
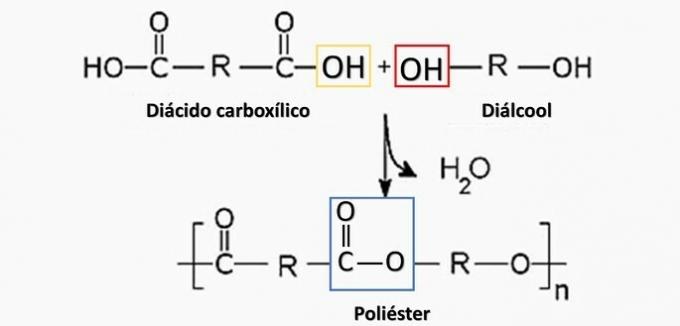
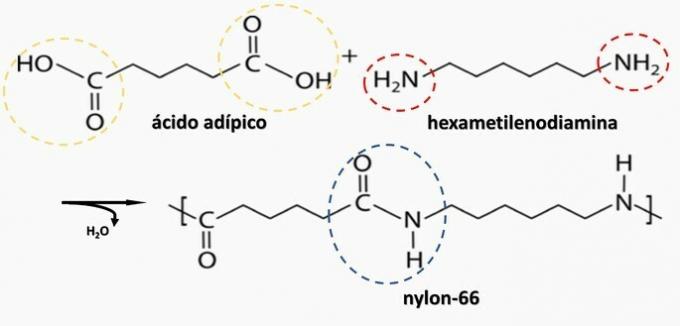
Kontrolirana razgradnja artefakta generiranog diaminom H2N (CH2)6NH2 i HO kiselina2C (CH2)4CO2H. Stoga je artefakt napravljen od
a) poliester.
b) poliamid.
c) polietilen.
d) poliakrilat.
e) polipropilen.
Ispravna alternativa: b) poliamid.
a) POGREŠNO. Poliester nastaje u reakciji između dikarboksilne kiseline (-COOH) i dialkohola (-OH).
b) TOČNO. Poliamid nastaje polimerizacijom dikarboksilne kiseline (—COOH) s diaminom (—NH2).
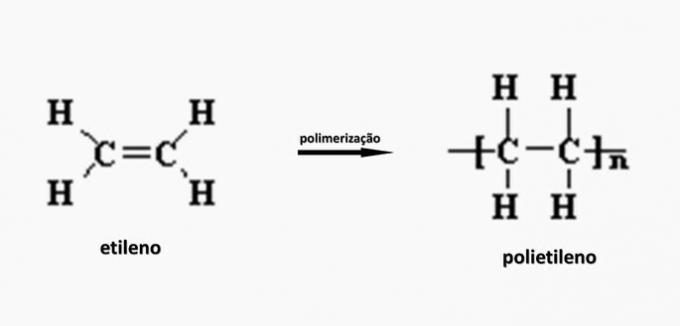
c) POGREŠNO. Polietilen nastaje u polimerizaciji etilen monomera.
d) POGREŠNO. Poliakrilat nastaje solju dobivenom iz karboksilne kiseline.
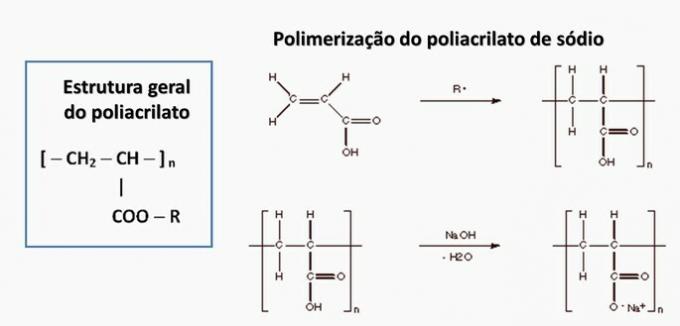
e) POGREŠNO. Polipropilen nastaje u polimerizaciji propilenskog monomera.
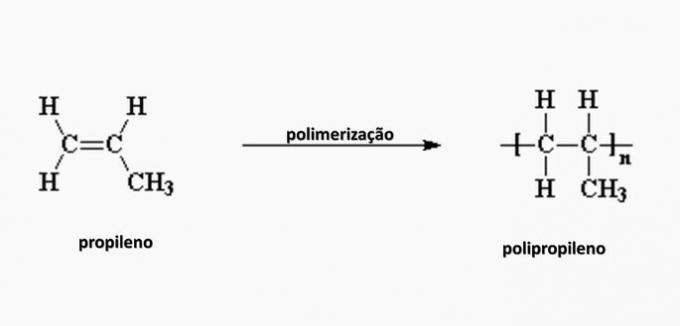
pitanje 4
(Enem / 2008) Kina se obvezala nadoknaditi štetu Rusiji za izlijevanje benzena iz neke industrije Kineska petrokemija u rijeci Songhua, pritoci rijeke Amur, koja čini dio granice između njih dvoje zemljama. Predsjednik Federalne agencije za vodne resurse Rusije uvjeravao je da benzen neće doći do cjevovoda pitke vode, ali je tražio od stanovništva da prokuha tekuću vodu i izbjegne ribolov u rijeci Amur i njezinoj pritoke. Lokalne vlasti pohranjuju stotine tona ugljena, jer se mineral smatra učinkovitim apsorberom benzena. Internet: (s adaptacijama). Uzimajući u obzir mjere donesene za smanjenje štete na okolišu i stanovništvu, ispravno je to tvrditi
a) ugljen, kad se stavi u vodu, reagira s benzenom, eliminirajući ga.
b) benzen je hlapljiviji od vode i zato ga treba prokuhati.
c) usmjerenost na izbjegavanje ribolova posljedica je potrebe za očuvanjem ribe.
d) benzen ne bi kontaminirao cijevi pitke vode, jer bi se prirodno dekantirao na dnu rijeke.
e) onečišćenje izazvano izlijevanjem benzena u kineskoj industriji bilo bi ograničeno na rijeku Songhua.
Ispravna alternativa: b) benzen je hlapljiviji od vode i zato je potrebno da se prokuha.
a) POGREŠNO. Ugljen u svojoj strukturi sadrži nekoliko pora i koristi se kao adsorbent, jer je sposoban komunicirati sa zagađivačima i zadržati ih na svojoj površini, ali ih ne uklanja.
b) TOČNO. Što je veća hlapljivost neke tvari, to se lakše mijenja u plinovito stanje. Dok je vrelište vode 100 ° C, benzena 80,1 ° C. To je zato što je voda polarni spoj, a benzen nepolarni spoj.
Vrsta interakcija koje molekule stvaraju su različite i također utječu na točku vrenja tvari. Molekula vode sposobna je stvoriti vodikove veze, vrsta interakcije mnogo jača od one koju benzen s induciranim dipolom može stvoriti.
c) POGREŠNO. U prehrambenom lancu jedno biće postaje hrana drugog sukladno interakciji vrsta na određenom mjestu. Kada se otrovna tvar pusti u okoliš, dolazi do progresivnog nakupljanja i ribe kontaminirani, kad ih čovjek proguta, mogu sa sobom ponijeti benzen i uzrokovati mutacije DNK, pa čak i čak i rak.
d) POGREŠNO. Benzen ima manju gustoću od vode. Dakle, trend je da se i pod vodom nastavlja širiti.
e) POGREŠNO. Sezonske promjene mogu dodatno povećati problem, jer niske temperature smanjuju sposobnost biološkog raspadanja kemikalija djelovanjem sunca ili bakterija.
5. pitanje
(Enem / 2019) Ugljikovodici su organske molekule s nizom industrijskih primjena. Na primjer, oni su prisutni u velikim količinama u raznim naftnim frakcijama i obično se odvajaju frakcijskom destilacijom na temelju njihove temperature vrenja. Tablica prikazuje glavne frakcije dobivene destilacijom nafte u različitim temperaturnim rasponima.
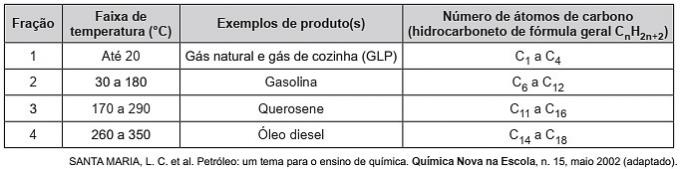
U frakciji 4 razdvajanje spojeva događa se pri višim temperaturama jer
a) njihove su gustoće veće.
b) broj grana je veći.
c) njegova je topljivost u ulju veća.
d) intermolekularne sile su intenzivnije.
e) ugljikov lanac je teže prekinuti.
Ispravna alternativa: d) intermolekularne sile su intenzivnije.
Ugljikovodici međusobno djeluju induciranim dipolom i ova vrsta intermolekularne sile pojačava se porastom ugljikovog lanca.
Stoga teže frakcije nafte imaju višu temperaturu ključanja, jer lanci jače međusobno djeluju induciranim dipolom.
Za više vježbi, s komentiranom rezolucijom, također pogledajte:
- Vježbe na ugljikovodicima
- Vježbe o organskim funkcijama
- Pitanja iz kemije u Enem-u
