Ugljični monoksid je zapaljiv i otrovni plin bez boje, mirisa i mirisa.
Njegova molekularna formula je CO. Sastoji se od molekule ugljika i kisika.
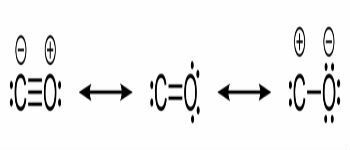
Strukturne formule ugljičnog monoksida i kemijske veze između ugljika i kisika
Nastaje na dva načina:
- Prirodni izvori emitiranja: aktivnost vulkana, prirodnog plina i električnog pražnjenja.
- ljudske aktivnosti: rezultat od izgaranje nepotpuna fosilna goriva. Izgaranjem se proizvode tone CO, što je jedna od glavnih aktivnosti koja ispušta CO u atmosferu.
Značajke
Ugljični monoksid spada u skupinu oksidi. Klasificirano je kao neutralni oksid, oni nastali od metala i kisika. Nadalje, ne reagira s vodom, kiselinama i bazama.
Koristi se kao redukcijsko sredstvo, uklanja kisik iz spoja i proizvodi ugljični dioksid (CO2). Stoga je njegova primjena u preradi ruda, poput željeza, vrlo česta. Kao i u proizvodnji organskih tvari, poput octene kiseline, plastike, metanola, između ostalog.
Pri reakciji s kisikom u zraku stvara ugljični dioksid. Prema sljedećoj kemijskoj reakciji: 2 CO + O2 → 2 CO2
U površinskim vodama visoka koncentracija ugljičnog monoksida služi kao izvor energije za mikroorganizme.
Ugljični monoksid jedan je od plinova efekt staklenika. Njegova koncentracija u atmosferi pridonosi većem zadržavanju topline. Stoga se smatra plinom koji zagađuje.
Intoksikacija
CO ima visok afinitet za hemoglobin. Budući da je otrovno, njegovo udisanje uzrokuje učinke na ljudsko zdravlje, a može dovesti i do smrti.
Budući da CO nema miris, možda se neprimjetno udiše. Stoga u nekim slučajevima osobi treba dugo vremena da primijeti opijenost.
Kada se udiše u maloj koncentraciji, uzrokuje migrene, polagano razmišljanje, iritaciju očiju i gubitak ručne sposobnosti. U visokim koncentracijama može izazvati napadaje, gubitak svijesti, pa čak i smrt od gušenja.
Ali kako se događa opijenost?
THE hemoglobin povezuje se, naravno, s O2 i transportira ga u tjelesna tkiva. Međutim, afinitet između CO i hemoglobina mnogo je veći, oko 250 puta veći nego kod O2.
U prisutnosti CO, hemoglobin se na njega veže, sprečavajući transport kisika do stanica. Kombinacija CO s hemoglobinom dovodi do karboksihemoglobina.
Glavni uzroci trovanja CO događaju se u sljedećim situacijama:
- Automobilski motori koji rade u zatvorenom;
- Opeklina od prirodni gas u neučinkovitim grijačima;
- Ispuh plina iz kuhinje ili peći na drva, u slabo prozračenim prostorima.
U zemljama s hladnom klimom kuće obično ostaju duže zatvorene i koriste sustave grijanja. Kako bi se izbjegle plinske nesreće, sve se više koriste detektori CO.
Saznajte više, pročitajte i:
- ciklus ugljika
- Ugljik
- Fosilna goriva
- Kisik



