Periodična svojstva kemijskih elemenata karakteristike su koje posjeduju.
Imajte na umu da kemijski elementi u periodnom sustavu imaju određeno mjesto koje varira ovisno o periodičkim svojstvima koja pokazuju. Razvrstani su po uzlaznom redoslijedu atomskog broja.
Prema Moseleyevom zakonu:
“Mnoga fizička i kemijska svojstva elemenata periodički se razlikuju u slijedu atomskih brojeva elemenata..”
Glavna periodična svojstva
atomski radijus
Povezano s veličinom atoma, ovo je svojstvo definirano udaljenostom između središta jezgara dvaju atoma istog elementa.
Stoga je atomska zraka odgovara polovici udaljenosti između jezgri dvaju susjednih atoma, izražavajući se na sljedeći način:
r = d / 2
Gdje:
r: munja
d: internuklearna udaljenost
Mjeri se u pikometri (pm). Ovo mjerenje je podmnožni mjerač:
13 sati = 10-12 m
U periodnom sustavu atomski radijus se povećava odozgo prema dolje u okomitom položaju. Na horizontali se povećavaju zdesna nalijevo.
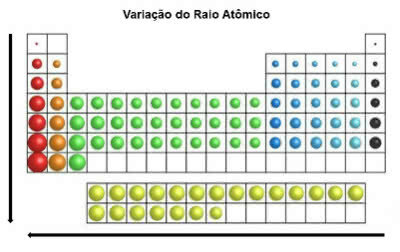
Varijacija atomskog radijusa
Kemijski element koji ima najveći atomski radijus je cezij (Cs).
Atomski volumen
Ovo periodično svojstvo označava zapreminu koju zauzima 1 mol elementa u krutom stanju.
Vrijedno je napomenuti da atomski volumen nije volumen od 1 atoma, već skup od 6,02. 1023 atomi (vrijednost 1 mol)
Atomski volumen atoma nije definiran samo volumenom svakog atoma, već i razmakom koji postoji između tih atoma.
U periodnom sustavu vrijednosti atomskog volumena povećavaju se od vrha prema dnu (okomito) i od središta do ruba (vodoravno).

Varijacija atomskog volumena
Za izračunavanje atomskog volumena koristi se sljedeća formula:
V = m / d
Gdje:
V: atomski volumen
m: masa 6,02. 1023 atomi elementa
d: gustoća čvrstih elemenata
Apsolutna gustoća
THE gustoća apsolut, također nazvan "specifična masa", periodično je svojstvo koje određuje odnos između mase (m) tvari i zapremine (v) koju ta masa zauzima.
Izračunava se prema sljedećoj formuli:
d = m / v
Gdje:
d: gustoća
m: tjestenina
v: volumen
U periodnom sustavu vrijednosti gustoće povećavaju se od vrha prema dnu (okomito) i od rubova do središta (vodoravno).
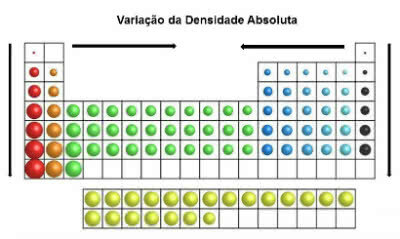
Apsolutna varijacija gustoće
Dakle, najgušći elementi su u središtu i na dnu tablice:
Osmij (Os): d = 22,5 g / cm3
Iridij (Ir): d = 22,4 g / cm3
Talište i vrelište
Sljedeće važno periodično svojstvo povezano je s temperaturama na koje elementi ulaze topljenje i ključanje.
Talište (MP) je temperatura pri kojoj tvar prelazi iz krute u tekuću fazu. Točka vrenja (PE) je temperatura pri kojoj tvar prelazi iz tekućine u plinovitu fazu.
U periodnom sustavu vrijednosti PF i PE variraju ovisno o tome koje su stranice smještene u tablici.
Okomito i na lijevoj strani stola povećavaju se od dna prema vrhu. S desne strane povećavaju se od vrha do dna. U vodoravnom smjeru protežu se od krajeva do središta.

Varijacija tališta i vrelišta
Elektronski afinitet
Naziva se i "elektroafinitet", to je minimalna energija potrebna kemijskom elementu kako bi se elektronu uklonio anion.
Odnosno elektronički afinitet označava količinu energije koja se oslobađa kad atom primi elektron.
Imajte na umu da je ovaj nestabilni atom sam i u plinovitom stanju. Ovim svojstvom stječe stabilnost kad primi elektron.
Za razliku od atomskog radijusa, elektroafinitet elemenata u periodnom sustavu raste slijeva udesno, vodoravno. U vertikalnom se smjeru povećava od dna prema vrhu.
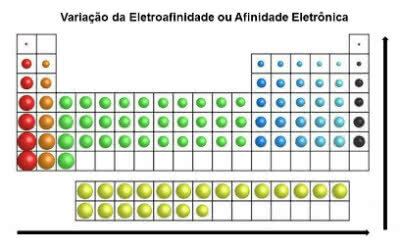
Elektronička varijacija afiniteta
Kemijski element koji ima najveći afinitet prema elektronama je klor (Cl), s vrijednošću od 349 KJ / mol.
Energija jonizacije
Također se naziva „ionizacijski potencijal”, Ovo je svojstvo suprotno svojstvu elektroničkog afiniteta.
To je minimalna energija potrebna kemijskom elementu za uklanjanje elektrona iz neutralnog atoma.
Dakle, ovo periodično svojstvo pokazuje koliko je energije potrebno za prijenos elektrona iz atoma u osnovnom stanju.
Takozvano "osnovno stanje atoma" znači da je njegov broj protona jednak broju elektrona (str+ = i-).
Dakle, nakon uklanjanja elektrona iz atoma, on se ionizira. Odnosno, dobiva više protona nego elektrona i stoga postaje kation.
U periodnom sustavu energija ionizacije suprotna je energiji atomskog radijusa. Tako se povećava slijeva udesno i odozdo prema gore.
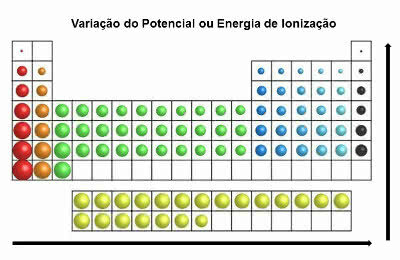
Varijacija energije jonizacije
Elementi koji imaju najveći potencijal ionizacije su fluor (F) i klor (Cl).
elektronegativnost
Svojstvo atoma elemenata koji imaju tendenciju primanja elektrona u kemijskoj vezi.
Javlja se u kovalentnim vezama u vrijeme dijeljenja elektronskih parova. Pri primanju elektrona, atomima ostaje negativan naboj (anion).
Imajte na umu da se to smatra najvažnijim svojstvom periodnog sustava. To je zato što elektronegativnost inducira ponašanje atoma od kojih nastaju molekule.
U periodnom sustavu, elektronegativnost povećava se slijeva udesno (vodoravno) i odozdo prema gore (okomito)
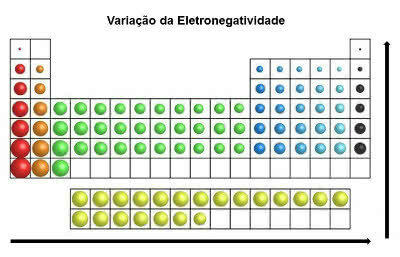
Varijacija elektronegativnosti
Dakle, najelektronegativniji element periodnog sustava je fluor (F). S druge strane, cezij (Cs) i Francij (Fr) najmanje su elektronegativni elementi.
elektropozitivnost
Za razliku od elektronegativnosti, ovo svojstvo atoma elemenata ukazuje na tendenciju gubitka (ili odricanja) elektrona u kemijskoj vezi.
Gubljenjem elektrona, atomi elemenata dobivaju pozitivan naboj, stvarajući tako kation.
U istom smjeru kao i atomski radijus i suprotno elektronegativnosti, u periodnom sustavu a elektropozitivnost povećava se zdesna ulijevo (vodoravno) i odozgo prema dolje (okomito).
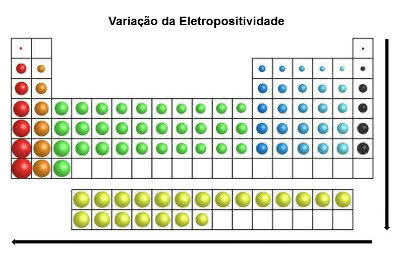
Varijacija elektropozitivnosti
Kemijski elementi s najvećom elektropozitivnošću su metali, pa se iz tog razloga ovo svojstvo naziva i "metalni karakter". Najpopozitivniji element je Francij (Fr) s maksimalnom tendencijom oksidacije.
Pažnja!
Ti "plemeniti plinoviSu inertni elementi, jer ne provode kemijske veze i teško doniraju ili primaju elektrone. Također, imaju poteškoće u reakciji s drugim elementima.
Stoga se elektronegativnost i elektropozitivnost ovih elemenata ne uzimaju u obzir.
Pročitajte i vi:
- Kemijske veze
- Povijest periodnog sustava
- Obitelji periodnog sustava
Aperiodna svojstva
Pored periodičnih svojstava, imamo i aperiodična svojstva. U ovom se slučaju vrijednosti povećavaju ili smanjuju s atomskim brojem elemenata.
Dobijaju ovo ime, jer se ne pokoravaju svom položaju na periodnom sustavu kao periodični. Odnosno, ne ponavljaju se redovito.
Glavna aperiodična svojstva su:
- Atomska masa: Ovo se svojstvo povećava s povećanjem atomskog broja.
- Određena toplina: ovo svojstvo opada s porastom atomskog broja. Imajte na umu da je specifična toplina količina topline potrebna za povećanje temperature za 1 ° C od 1 g elementa.
Vježbe prijamnog ispita s povratnim informacijama
1. (PUC-RJ) Razmotrite izjave o elementima skupine IA u Periodnom sustavu
Ja Zovu se alkalni metali.
II. Njegove atomske zrake rastu s atomskim brojem.
III. Njegov ionizacijski potencijal raste s atomskim brojem.
IV: Njegov metalni karakter raste s atomskim brojem.
Među izjavama su istinite:
a) I i II
b) III i IV
c) I, II i IV
d) II, III i IV
e) I, II, III i IV
Alternativa c
2. (UFMG) Uspoređujući klor i natrij, dva kemijska elementa koja tvore kuhinjsku sol, možete reći da klor:
a) je gušća.
b) manje je hlapljiv.
c) ima veći metalni karakter.
d) ima nižu energiju jonizacije.
e) ima manji atomski radijus.
Alternativni i
3. (UFC-CE) Fotoelektrični efekt sastoji se od emisije elektrona s metalnih površina, kroz pojavu svjetlosti odgovarajuće frekvencije. Na ovu pojavu izravno utječe ionizacijski potencijal metala, koji je u velikoj mjeri bio koristi se u proizvodnji fotoelektronskih uređaja, kao što su: fotoćelije za javnu rasvjetu, fotoaparati fotografski itd. Na temelju varijacije ionizacijskog potencijala elemenata u Periodnom sustavu, označite alternativu koja sadrži metal koji će najvjerojatnije pokazivati fotoelektrični efekt.
a) Fe
b) Hg
c) Cs
d) Mg
e) Ca
Alternativa c
Pitanja za prijamni ispit provjerite s komentarom u rješenju Vježbe na periodnom sustavu i neobjavljena pitanja na tu temu u Vježbe o organiziranju periodnog sustava.
Pročitajte i vi:
- Periodni sustav elemenata
- Eletronic distribucija
- Kemijski elementi
- Intermolekularne sile