Tekst Titracija pokazao je kako se izvodi ova tehnika volumetrijske analize čiji je glavni cilj identificirati koncentraciju otopine kroz njezinu reakciju s drugom otopinom poznate koncentracije.
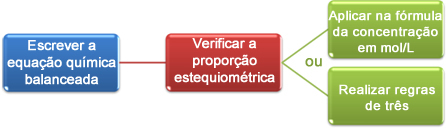
Sada ćemo vidjeti kako koristiti podatke dobivene titracijom da bismo postigli željenu koncentraciju, koja može biti kiselina ili baza u otopini. Da biste to učinili, u osnovi su tri koraka:
Pogledajmo primjer:
Recimo da je kemičar imao otopinu octene kiseline (ocat (CH3COOH(ovdje))) i želio je saznati njegovu koncentraciju u mol / L. Zatim je stavio 20,0 ml octa (titriranog) u Erlenmeyerovu tikvicu i dodao pokazatelj fenolftaleina. Zatim je 100 ml birete napunio natrijevim hidroksidom (NaOH) poznate koncentracije (titrant) jednake 1,0 mol / L. Konačno, kemičar je izvršio titraciju i primijetio da se promjena boje (prijelomna točka - kad je zaustavio titraciju) dogodila kada se potroši 24 ml NaOH.

Na temelju ovog eksperimenta dobio je sljedeće podatke:
MCH3COOH= ?
VCH3COOH = 20 ml = 0,02 L
MNaOH = 24 ml = 0,024 L
VNaOH = 1,0 mol / L
Gdje je M = koncentracija u mol / L i V = volumen u L.
Da bismo saznali koncentraciju octene kiseline, prvo moramo znati napisati kemijsku jednadžbu koja predstavlja pravilno uravnoteženu reakciju neutralizacije koja se dogodila. U ovom slučaju reakcija je sljedeća:
1 CH3COOH(ovdje) + 1 NaOH(ovdje) → 1 NaC2H3O2 (vod.) + 1 sat2O(ℓ)
Ovaj je dio važan kako bi se vidio stehiometrijski omjer pri kojem reagensi reagiraju. Imajte na umu da je omjer 1: 1, odnosno za svaki mol octene kiseline potreban je 1 mol natrijevog hidroksida.
Sada kalkulacije možemo nastaviti na dva načina:
(1.) Kroz formulu: M1. V1 = M2. V2
Budući da je stehiometrijski omjer 1: 1, moramo: NeCH3COOH = nNaOH .
Biće M = n / V → n = M. V. Tako dolazimo do gornjeg popisa, koji se u ovom slučaju može napisati ovako: MCH3COOH. CH3COOH = MNaOH. VNaOH
Dakle, samo zamijenite vrijednosti ove formule:
MCH3COOH. V CH3COOH = MNaOH. VNaOH
MCH3COOH. 0,02 L = 1,0 mol / L. 0,024 L
MCH3COOH = 0,024 mol
0,02 L
MCH3COOH = 1,2 mol / L
Stoga je početna koncentracija otopine octene kiseline, naš naslov, bila 1,2 mol / L.
Važna nota: Ako stehiometrijski omjer nije 1: 1, bilo bi dovoljno pomnožiti koncentraciju tvari u mol / L (M) s njihovim koeficijentima. Na primjer, da je omjer 1: 2, imali bismo sljedeće:
M1. V1 = 2. M2. V2
Ali evo još jednog načina za izvođenje ovih izračuna:
(2.) Kroz pravila tri:
1 CH3COOH(ovdje) + 1 NaOH(ovdje) → 1 CH3COONa(ovdje) + 1 sat2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60g 1. 40 g 1. 82 g 1. 18 g
Te su mase izračunate molekularne mase za svaku tvar.
* Znajući da je potrošeni volumen 1,0 mol / L otopine NaOH(ovdje) bio 24 ml, prvo možemo saznati količinu tvari (mol) NaOH koja je reagirala:
1 mol NaOH → 1,0 L
1 mol NaOH 1000 ml
x 24 ml
x = 0,024 mola NaOH
* Budući da je omjer 1: 1, količina tvari (mol) octene kiseline trebala bi biti jednaka NaOH: 0,024 mol.
Promatranje: Da su stehiometrijski omjeri različiti, mi bismo to uzeli u obzir u ovom dijelu. Na primjer, ako je bilo 1: 3, a količina tvari jedne kemijski reaktivne vrste bila je jednaka 0,024 mola, tada bi količina druge tvari bila trostruka: 0,072.
* Sada izračunavamo:
20 ml octa 0,024 mola octene kiseline
1000 ml octa i
y = 1,2 mol
Odnosno, postoji 1,2 mol / L, što je ista vrijednost koju smo dobili u prethodnoj metodi.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/calculos-envolvidos-na-titulacao.htm

