Neki spojevi imaju u svojoj strukturi dvostruke veze koje se izmjenjuju s jednostrukim vezama. Najpoznatiji od svih je benzen, čiju je strukturu 1865. godine predložio njemački kemičar Friedrich August Kekulé (1829. - 1896.). Njegova bi struktura bila ciklična i formirana bi od tri dvostruke veze ispresijecane s tri pojedinačne veze, kao što je prikazano na slikama ispod:
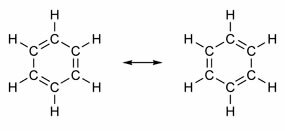
Oba su načina predstavljanja benzena prihvatljiva, jer je moguće promijeniti elektrone u π vezama bez promjene položaja atoma. Međutim, niti predstavlja točno ono što jest niti objašnjava njegovo ponašanje. Trebao bi se ponašati kao alken i izazivati reakcije dodavanja, ali u praksi se to ne događa. Benzen je prilično stabilan i ponaša se kao da nema dvostruke veze; daje reakcije supstitucije kao kod alkana.
Godine 1930. američki je znanstvenik Linus Pauling predložio teoriju rezonancije koja je objasnila ovu očitu kontradikciju. Ova teorija je rekla:
„Kad god u strukturnoj formuli možemo promijeniti položaj elektrona bez promjene položaja atoma , stvarna struktura Ne neće biti niti jedna od dobivenih struktura, već a rezonancijski hibrid tih struktura. "
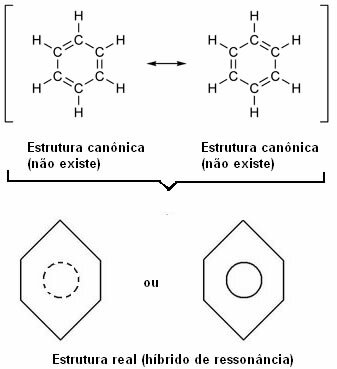
Ovaj učinak dokazuje veličina ugljikovih veza i udaljenost između njih. Ova udaljenost je srednja u odnosu na jednostruku vezu (1,54 Å) i dvostruku vezu (1,34 Å); koja je, dakle, 1,39 Å, zbog efekta rezonancije.
Taj se učinak može vidjeti i u strukturi molekule ozona (O3), kako je prikazano dolje:
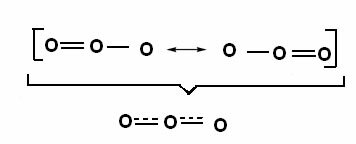
Kanonske strukture i hibridi ozonske rezonancije.
Napisala Jennifer Fogaça
Diplomirao kemiju
Brazilski školski tim.
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm
