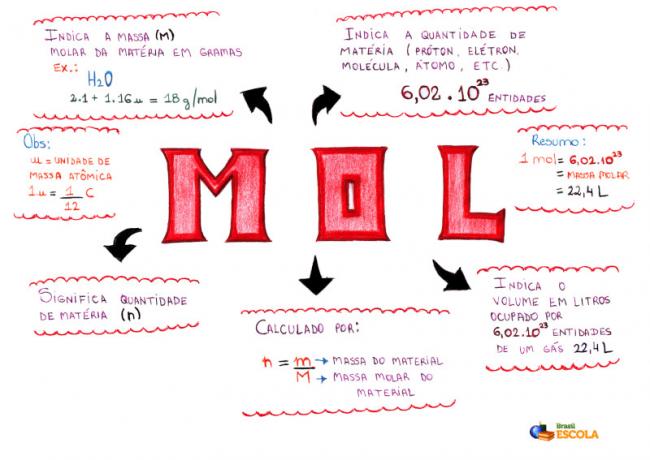
Izomerizam to je prirodni fenomen u kojem različite tvari (u pogledu kemijskih i fizikalnih svojstava) imaju potpuno istu molekulsku formulu, kao u sljedećem primjeru:
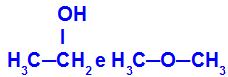
Različite tvari koje imaju istu molekularnu formulu
Etanol (lijevo) ima molekulsku formulu C2H6O, što se također događa s metoksietanom (desno), pa su oni izomeri.
Vrste izomerije
→ ravni izomer
Tip izomerije proučava strukturne razlike između izomera.
The) Okupacija
To je vrsta ravne izomerije u kojoj se razlika između tvari temelji na razlici između organskih funkcija kojima pripadaju. Pogledajte nekoliko primjera:
Propanon i propan:
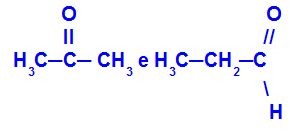
Izomeri koji pripadaju različitim funkcijama
Propanon (lijevo) pripada ketonskoj skupini, a propanal (desno) pripada aldehidnoj skupini.
B) Zatvor
To je vrsta ravne izomerije u kojoj se razlika između tvari temelji na razlici između lanaca koje predstavljaju. Pogledajte primjer:
2-metil-propan i butan
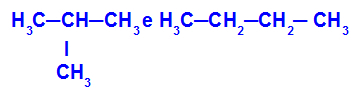
Izomeri koji imaju lance s različitim klasifikacijama
U primjeru možemo vidjeti da 2-metil-propan (slijeva) ima razgranati lanac, a butan (zdesna) normalan lanac.
ç) Položaj
To je vrsta ravne izomerije u kojoj se razlika između tvari temelji na razlici u položaju komponente koja je prisutna u njihovim lancima. Pogledajte primjer:
1-kloro-propan i 2-kloro-propan
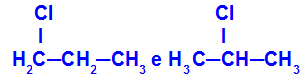
Izomeri koji imaju komponente na različitim položajima u lancu
U primjeru možemo vidjeti da 1-kloro-propan (slijeva) ima klor smješten na ugljiku 1, a 2-kloro-propan (zdesna) klor smješten na ugljiku 2.
d) Metamerija ili naknada
BILJEŠKA: Izomer vrijedi isključivo za heterogene žice.
To je vrsta ravne izomerije u kojoj se razlika između tvari temelji na razlici u položaju heteroatoma koji je prisutan u njihovim lancima. Pogledajte primjer:
Primjer: Metoksipropan i etoksietan
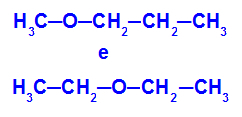
Izomeri koji imaju heteroatome na različitim položajima u lancu
U primjeru možemo vidjeti da u metoksipropanu (lijevo) kisik ima radikal s jednim ugljikom na jednoj i tri ugljika s druge strane. U etoksietanu (desno) kisik ima radikal s dva ugljika s jedne i dva ugljika s druge strane.
i)Tautomerija
To je osobiti slučaj izomerije ravni funkcije i javlja se u samo tri organske funkcije:
Aldehid
keton
Enol
Ova vrsta izomerije djeluje na činjenicu da postoji kemijska ravnoteža između enola i aldehida te između enola i ketona, odnosno te se komponente neprestano pretvaraju jedna u drugu. Pogledajte primjer:
Prop-2-en-1-ol i propanon
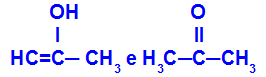
Izomeri koji pripadaju različitim funkcijama
U primjeru možemo vidjeti da Prop-2-en-1-ol (slijeva) pripada skupini enola, a propanon (zdesna) skupini ketona, pa su oni izomeri tautomerije.
→ Svemirska izomerija
To je vrsta izomerije definirana prostornom analizom molekule.
a) Geometrijski izomeri
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
To je vrsta prostorne izomerije koja se javlja kada tvar ima molekule sa sljedećim karakteristikama:
Zatvoreni lanac koji ima dva ugljika s dva različita liganda, kao u donjem primjeru:

Zatvorena struktura s geometrijskom izomerijom
Otvoreni lanac koji ima dvostruku vezu između ugljika i u svakom od ovih ugljika dvostruke veze postoje dva različita liganda, kao u primjeru dolje:
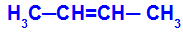
Otvorena struktura s geometrijskom izomerijom
Geometrijska izomerija podijeljena je u dvije skupine:
1O Skupina: cis-trans
To se događa kada su dva liganda jednog ugljika strogo jednaka dvama ligandima drugog ugljika, bilo u otvorenoj strukturi ili u zatvorenoj strukturi.
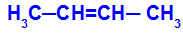
Lanac tvari koja ima cis-trans izomeriju
Izomer će se zvati cis kada su isti ligandi u istoj ravnini.

Primjer cis izomera
Izomer će se zvati trans kada su različiti ligandi u istoj ravnini.

Primjer trans izomera
2O Skupina: E-Z
To se događa kada su dva liganda jednog ugljika različita u odnosu na dva liganda drugog ugljika, bilo u otvorenoj strukturi ili u zatvorenoj strukturi.

Lanac tvari koja ima E-Z izomerizam
Izomer će se zvati E kad su ligandi s najvećim atomskim brojem u suprotnim ravninama. U donjem primjeru ugljik slijeva ima Br s najvećim atomskim brojem (35), a u drugom je kisik (8).
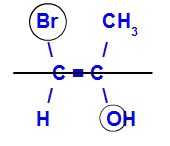
Primjer E-izomera
Izomer će se zvati Z kad su ligandi s najvećim atomskim brojem u istoj ravnini. U donjem primjeru ugljik slijeva ima Br s najvećim atomskim brojem (35), a u drugom je kisik (8).

Primjer Z-izomera
B) optički izomer
To je vrsta prostorne izomerije koja se javlja samo ako tvar ima molekule s kiralni ugljik (onaj koji ima četiri različita liganda) u svojim strukturama. Molekula s kiralnim ugljikom ima sposobnost polarizacije i odbijanja svjetlosti, kako slijedi:
Desno (desnoruki izomer)
Lijevo (okrećući izomer)
Spoj s optičkom aktivnošću uvijek ima aktivni izomeri (zvani optički antipodi) i neaktivni izomeri (smjesa između dva aktivna izomera, smjesa koja se naziva racemična).
Sljedeću formulu možemo koristiti za određivanje broja aktivnih (IOA) i neaktivnih (IOI) izomera spoja koji ima kiralni ugljik:
IOA = 2Ne
IOI = 2Ne
2
Ispod je primjer spoja koji ima geometrijsku izomeriju:
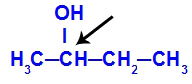
Kiralni ugljik sadržan u butan-2-olu
Struktura butan-2-ola ima sljedeće ligande:
Metil (CH3)
Etil (CH3-CH2)
Vodik (H)
Hidroksil (OH)
Budući da ima samo jedan kiralni ugljik, butan-2-ol ima:
Aktivni izomeri:
IOA = 21
IOA = 2
Neaktivni izomeri:
IOI = 21
2
IOI = 2
2
IOI = 1
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Što je izomerija?"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Pristupljeno 27. lipnja 2021.