Na ionske tvari su oni koji imaju barem jednu ionsku vezu, odnosno kada postoji konačni prijenos elektrona iz jednog u drugi atom, tvoreći ions. Atom elementa koji je izgubio elektrone poprima pozitivan naboj i predstavlja ion koji se naziva kation, dok je atom koji je primio elektrone, dobivajući negativan naboj, anion.
Oni postoje jednostavni ioni (nastaje samo od atoma) i složeni ioni (nastale skupinama atoma različitih kemijskih elemenata koji su zajedno stekli ili izgubili jedan ili više elektrona). Ispod je tablica s popisom aniona i kationa, jednostavnih i složenih, koji čine ionske spojeve.

Tablica aniona koji tvore ionske tvari

Tablica kationa koji tvore ionske tvari
Među gore prikazanim anionima najvažniji su: klorid, karbonat, nitrat i sulfat. Oni se vežu s elementima koji su manje elektronegativni od njih i tvore glavne soli koje se nalaze u prirodi i u našem svakodnevnom životu. Klorid je jednostavan anion, dok su ostale skupine svi složeni anioni.
Vas soli su anorganske ionske tvari koje prema tteorija Arrhenius-ove elektrolitske disocijacije, mogu se definirati kao spojevi koji u vodenom mediju oslobađaju barem jedan kation koji nije H+ (ili H3O+) i najmanje jedan anion osim OH-.
Soli koje tvore spojeni anioni imaju ionske i kovalentne veze, a anioni nastaju pomoću kovalentne veze (s dijeljenjem elektrona), a veza između ovih aniona i metala ili polumetala je ionska.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
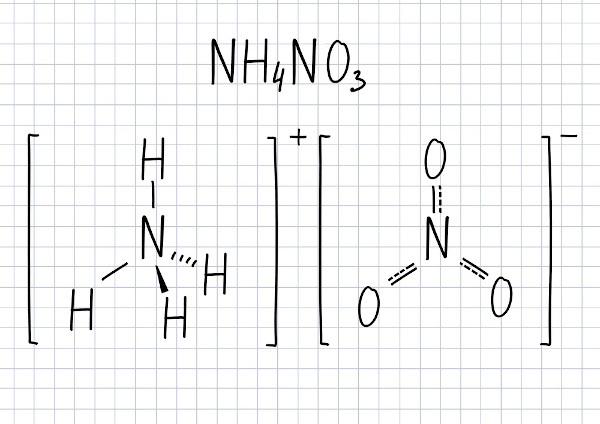
Na primjer, natrijev nitrat (NaNO3) nastaje ionskom vezom između natrijevog kationa (Na+) i nitrat anion (NO3-), uz prijenos elektrona. Imajte na umu da postoji ova ionska veza, ali veza koja tvori anion je kovalentna:

To je, međutim, samo formula jedinice. Jonske tvari zapravo se lijepe, tvoreći velike nakupine dobro definiranih geometrijskih oblika koje se nazivaju kristalne rešetke. To se događa zbog elektrostatske privlačnosti koja postoji između ovih suprotnih nabojnih naboja, ioni završavaju privlačeći najbliže, tvoreći te rešetke, u kojima je nekoliko aniona oko kationa i obratno. Količina iona koja okružuje ion suprotnog naboja naziva se koordinacijski broj.
Na primjer, slijedi sol bakrenog sulfata (CuSO4) i ilustracija vašeg kristalnog retikuluma:

Zbog ovih rasporeda, ionske tvari imaju sljedeća glavna svojstva:
Oni su čvrsti na sobnoj temperaturi;
Imaju visoka tališta i vrelišta;
Oni su tvrdi i lomljivi;
Oni provode električnu struju kada su otopljeni u vodi i kada su rastopljeni.
Ispod imamo tekstove koji objašnjavaju kako nastaju kloridni, karbonatni, nitratni i sulfatni anioni, njihov sastav, svojstva, izvori, važnost, primjena i primjeri ionskih tvari koje sadržavati. Pristupite svakom od njih kako biste bili u toku sa svim ovim detaljima:
* Kloridi;
* Karbonati;
* Nitrati;
* Sulfati.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Jonske tvari skupine: klorid, karbonat, nitrat i sulfat"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/substancias-ionicas-grupo-cloreto-carbonato-nitrato-sulfato.htm. Pristupljeno 27. lipnja 2021.
Jonski spojevi, glavne karakteristike ionskih spojeva, veza između iona, konačni prijenos elektrona, elektrostatičke privlačne sile između iona, negativnih i pozitivnih iona, anioni, kationi, ionska veza, molekularna struktura on
Kemija

Disocijacija i jonizacija, talijanski znanstvenik Volta, električna struja, švedski fizikalni kemičar Svant August Arrhenius, teorija Arrhenius, pozitivni ioni, kationi, negativni ioni, anioni, kaustična soda, kuhinjska sol, polarne molekule, disocijacija ionski,
Kemija

Jonska veza, raspored između ionskih spojeva, ionskih aglomerata, natrijevog klorida, kuhinjske soli, ionske tvari, elektrostatičke privlačne sile, kloridni anioni, natrijevi kationi, polarna otapala, pozitivni ioni, kationi, negativni ioni, anioni.