Ugljik je kemijski element s atomskim brojem (Z) jednakim 6, što znači da atomi koji ga tvore imaju šest protona u svojoj jezgri. Njegova molarna masa iznosi 12.011 g / mol, a u prirodi se nalaze tri izotopa ugljika, a to su: o ugljik-12, ugljik-13 i ugljik-14. C-12 ima šest protona i šest neutrona u jezgri i najzastupljeniji je.
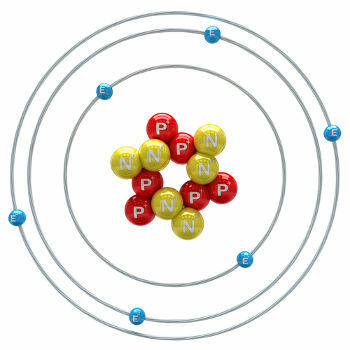
ilustracija atoma ugljika-12
C-13 ima sedam neutrona i najmanje ga ima (1,01 do 1,14%). C-14 ima osam neutrona i je a radioaktivni element koji emitira β čestice (elektrone), nastajući u Zemljinoj stratosferi kad neutroni kozmičkih zraka bombardiraju Dušik-14 prisutan u tim gornjim slojevima atmosfere. Sadrže ga sve biljke i životinje, a znajući da mu vrijeme poluraspada iznosi oko 5730 godina, koristi se za određivanje starosti fosila između 100 i 40 000 godina. Više detalja o C-14 i tehnici spojeva može se vidjeti u tekstu. Što je ugljik-14?
Ugljik je četverovalentni, odnosno potrebna su mu još četiri protona u svom valentnom sloju (najudaljeniji sloj) da bi se pokoravao pravilu okteta. Stoga obično stvara četiri kovalentne veze, dijeleći četiri para elektrona s drugim elementima, kao i s drugim ugljicima. Te veze mogu biti jednostruke, dvostruke ili trostruke i rezultiraju stvaranjem milijuna različitih spojeva. Iz tog je razloga stvoreno područje kemije,
Organska kemija, koji proučava glavne spojeve dobivene iz ugljika, s izuzetkom nekih slučajeva koji su mineralnog podrijetla, poput ugljični dioksid (CO2), O ugljični monoksid (CO), O kalcijev karbonat (CaCO3), natrijev hidrogenkarbonat ili natrijev bikarbonat (NaHCO3), između ostalih. Ovi spojevi su proučavani u Anorganska kemija.Ugljik izvodi alotropiju, tvoreći jednostavne tvari, odnosno tvari koje nastaju samo vezama između atoma ugljika. Postoji najmanje sedam alotropa ugljika, a to su grafit (alfa i beta), dijamant, lonsdaleit (heksagonalni dijamant), kaoit, ugljik (VI) i fulereni. Zapravo postoji nekoliko vrsta fulerena, koji su sintetski alotropni oblici ugljika. Imaju poliedarsku strukturu s atomom ugljika na svakom vrhu, a primjer je Ç60 pozvao buckminsterfullerene, a njegova struktura izgleda poput nogometne lopte.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
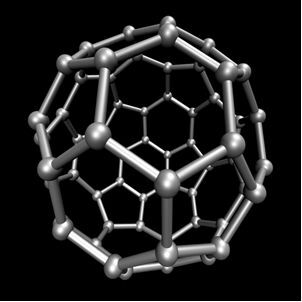
Ugljik-60 (buckminsterfullerene)
Međutim, među ovim alotropima ugljika postoje samo dvije prirodne. grafitTo je od Dijamant. Oni se razlikuju samo po kristalnom rasporedu atoma u prostoru, kao što je prikazano na donjoj slici, a to rezultira potpuno različitim fizikalno-kemijskim svojstvima. Pročitaj tekst alotropija ugljika za više informacija.

Dva prirodna alotropna oblika ugljika su grafit i dijamant.
Sljedeći sintetski alotropni oblik ugljika je nanocijevi (slika dolje) koje imaju široku biološku primjenu, uključujući medicinsku dijagnostiku i liječenje.

Ilustracija mikroskopske ugljične nanocijevi
Tako, ugljik je prisutan u svemu oko nas i u nama, jer on komponuje prirodni organski spojevi - kao što su fosilna goriva, koja uključuju naftu, ugljen i prirodni plin, i druga goriva poput etanola i biogoriva - poljoprivrednih proizvoda, između ostalog. oblik također sintetski organski spojevi, kao što su sintetička vlakna koja čine tkanine, lijekovi, polimeri koji čine plastiku i gumu, insekticidi, boje i još mnogo toga. Unutar nas, životinja i povrća, ugljik tvori vrlo važne spojeve, poput ugljikohidrata, poput šećera, glukoze i celuloze; proteini koji tvore, na primjer, DNK i zajedno s lipidima tvore membrane crvenih krvnih stanica i bijelih krvnih stanica.
Sve to pokazuje važnost ugljika za održavanje života. Ali to je povezano i s negativnim aspektima, poput intenziviranja efekt staklenika a posljedično globalno zatopljenje, to je zato što je glavni negativac tih problema njegov spoj ugljičnog dioksida (CO2). Uglavnom zbog velikog sagorijevanja fosilnih goriva koja oslobađaju taj plin, koncentracija CO2 u atmosferi se povećao. Kao staklenički plin uzrokuje spomenute probleme. S druge strane, ugljični dioksid također je prisutan u vitalnim reakcijama poput fotosinteze i disanja.
Napisala Jennifer Fogaça
Diplomirao kemiju

