Francuski kemičar Joseph Louis Proust (1754. - 1826.) nastavio je provoditi pažljive eksperimente koji se odnose na mase komponenata određenih reakcija.
Na primjer, elementi koji čine vodu su vodik i kisik. Proust je otkrio da je u ovoj reakciji stvaranja vode vodik uvijek reagirao s kisikom u konstantnom i određenom omjeru, koji je bio 1: 8. Pogledajte kako se to događa u nastavku:

Primijeti da bez obzira na masu korištenih elemenata, udio će uvijek biti jednak.
Proust je primijetio da to nije bio slučaj samo s vodom, već i sa svim ostalim tvarima.
15,06 g bakar sulfida (CuS) nastaje, na primjer, reakcijom 10,00 g metalnog bakra (Cu) s 5,06 g sumpora (S). Dakle, ako udvostručimo količinu bakra (koja će ići na 20,0 g) i ako želimo da sav bakar reagira, također će biti potrebno udvostručiti količinu sumpora, na 10,12 g, s ukupnim stvaranjem 30,12 g sulfid.
Ako se doda iznos koji nije proporcionalan, višak će ostati, neće reagirati. Imajte na umu ovo u nastavku:
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
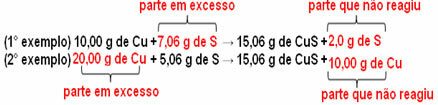
Primijeti da reakcija se odvija samo prema definiranom omjeru. Stoga je 1799. Proust zaključio da, kada se nekoliko tvari kombinira i tvori spoj, to se uvijek radi u definiranom masenom odnosu.
Tako je stvorio Zakon koji se zove Proustov zakon, Zakon stalnih proporcija ili Zakon definiranih proporcija, koji je naveden kako slijedi:

Ovaj zakon i Lavoisierov zakon (Zakon o očuvanju mase) su imenovani Zakoni o težini, jer govore u masi uključenih tvari.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Proustov zakon ili zakon stalnih proporcija"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Pristupljeno 27. lipnja 2021.