Za klasificirati sigma vezu, bitno je znati ga prepoznati u strukturi molekule. Sigma veza je zapravo kovalentna veza koja nastaje kad se nađu dvije nepotpune atomske orbitale (sa samo jednim elektronom) prodiru na istoj osi. Primjer je kada se orbitala p-tipa (helix) međusobno prožima s drugom p-orbitalom.

p orbitale koje se međusobno prožimaju u p-p sigma-vezi
U praksi (u vježbama), prepoznavanje i klasifikacija sigma veze izrađuje se iz strukturne formule tvari, kao u strukturnom prikazu dolje:

Strukturna formula cijanovodične kiseline
Prije klasifikacije sigma veze, potrebno ga je znati prepoznati u strukturnoj formuli. Za ovo se samo sjetite načine poput a kovalentna veza je zastupljen: Poziv jednostavan je predstavljen jednom crticom (-), par predstavljen je s dva (=) i poveznicom utrostručiti predstavljen je s tri (≡). Sigma veza prisutna je u bilo kojem od tri prikaza kovalentnih veza kako slijedi:
Jednostavan: ima sigma vezu;
Par: Od dvije poveznice, samo je jedna sigma;
Utrostručiti: Jedna od tri poveznice je sigma.
Znajući kako prepoznati sigma vezu, sljedeći je korak naučiti kako je rangirati. Za to moramo znati koja je nepotpuna orbitala svakog atoma koji je uključen u vezu:
H - predstavlja nepotpunu s orbitalu, pa je u klasifikaciji predstavljena s.
Ametali- imaju nepotpunu p orbitalu, pa ih u klasifikaciji predstavlja p, izuzev sljedećih elemenata:
Ugljik: Vaša nepotpuna orbitala ovisi o vrsti hibridizacija da pati. Mogućnosti su: sp hibridizacija3 (koliko košta četiri jednostavna poziva), sp2 (koliko čini dvije jednostruke i jednu dvostruku vezu) ili sp (koliko izvodi dvije dvostruke veze ili jednu jednostruku i jednu trostruku). Dakle, u klasifikaciji sigma veze Carbon može biti predstavljen sp3, sp2 ili sp, ovisno o pozivu koji upućujete.
Berilijum:patiti hibridizacija sp tipa, tako da je u klasifikaciji predstavljen sp.
Bor:patiti hibridizacija sp tipa2, tako da je u klasifikaciji predstavljen sp.2.
Uz sve ove informacije, najlakši je dio klasificirati sigma veze prisutne u strukturi. Pogledajmo nekoliko primjera:
Primjer 1: sigma veze u vodi

Strukturna formula vode
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Gornja strukturna formula pokazuje da voda ima dvije sigma veze (dva jednostavna), budući da su oni između kisika (koju predstavlja str) to je Vodik (koju zastupa s). Dakle, imamo dvije sigma veze klasificirane u:
s-str
Primjer 2: Sigma veze u fosforu trikloridu

Strukturna formula fosfor-triklorida
Gornja strukturna formula pokazuje da fosfor triklorid ima tri pozivasigme (tri jednostavna), budući da su oni ući u Fosfor (koju predstavlja str) to je klor (koju predstavlja str). Dakle, imamo tri sigma veze klasificirane u:
p-p
Primjer 3: sigma veze u bor trifluoridu
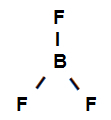
Strukturna formula bornog trifluorida
Gornja strukturna formula pokazuje da bor trifluorid ima tri sigma veze (tri jednostavna), budući da su oni unesite bor (koju zastupa sp2) to je Fluor (koju predstavlja str). Dakle, imamo tri sigma veze klasificirane u:
p-sp2
Primjer 4: sigma veze u etanolu
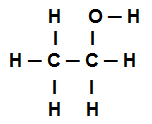
Strukturna formula etanola
Gornja strukturna formula za etanol pokazuje da imamo osam poziva sigme (osam jednostavnih poveznica). Jesu li oni:
Jedan među kisikom (predstavljeno p) i vodik (koju zastupa s). Dakle, veza je klasificirana u sigma s-p.
Jedan od dva ugljika koji izvode samo sigma veze (a zatim koju zastupa sp3). Dakle, veza je klasificirana u sp3-P3.
Jedan među ugljikom (koju zastupa sp3) i kisika (koju predstavlja str). Dakle, sigma veza se klasificira u p-sp3.
pet između ugljika (koju zastupa sp3) i vodik (koju zastupa s). Dakle, svih pet klasificirano je u s-sp3.
Primjer 5: Sigma veze u dikloroetenu

Strukturna formula dikloroetena
Strukturna formula dikloroetena gore pokazuje da imamo prisutnost pet sigma poveznica (četiri jednostruke veze i jedna od dvostrukih). Jesu li oni:
Jedan od dva ugljika koji čine dvije jednostruke i jednu dvostruku vezu (a zatim koju zastupa sp2). Dakle, sigma veza se klasificira u sp2-P2.
Četiri su između ugljika(koju zastupa sp2)i vodik (predstavljeno s). Dakle, sva četiri su svrstana u s-sp2.
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Klasifikacija sigma veze"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm. Pristupljeno 28. lipnja 2021.