Atomi su beskrajno male čestice koje čine svu materiju u svemiru. Vremenom se ideja o tome kakva bi bila atomska struktura promijenila prema novim otkrićima znanstvenika. O tome možete saznati više u tekstuEvolucija atomskog modela.
Model je prikaz stvarnosti (a ne sama stvarnost), pa su atomski modeli reprezentacija glavne komponente atoma i njegovu strukturu te objašnjavaju određena fizikalna i kemijska ponašanja materije. To je učinjeno jer ljudsko biće još nije moguće vidjeti izolirani atom čak ni uz ultramikroskope.
Da biste dobili ideju koliko je atom mali, znajte to The Najmanja čestica vidljiva pod običnim mikroskopom sadrži preko deset milijardi atoma! Atom je toliko malen da, kad bismo ih stavili jedan kraj drugog, ne bismo stigli do debljina dlake.
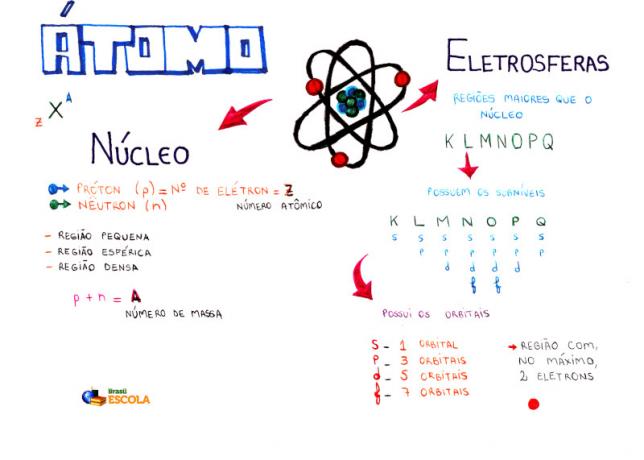
Mapa uma: Atom
* Za preuzimanje mape uma u PDF-u, Kliknite ovdje!
Među atomskim modelima, koji se trenutno koristi u srednjoj školi za razumijevanje strukture atoma i njegovih svojstava je Rutherford-Bohrov model. Prema ovom modelu, struktura atoma sastoji se od dva glavna dijela: jezgra i elektrosfera.

Dva glavna dijela strukture atoma - elektrosfera i jezgra
* Jezgra: Sastoji se kao središnji dio atoma, kompaktan je, masivan i vrlo gust, uz to što ga tvore čestice veće mase, a to su protoni i neutroni.

Prikaz protona i neutrona koji čine atomsku jezgru
- protoni: to su čestice s pozitivnim električnim nabojem (relativni naboj = +1; naboj u kulonu (C) = +1,602. 10-19) a njegova relativna masa jednaka je 1.
Činjenica da protoni čine jezgru i daju joj ukupni pozitivni naboj otkrio je Eugen Goldstein, 1886. modifikacijom Crookesove ampule i nekim eksperimentima. Vidio je da se pod vrlo visokim naponima pojavljuju emisije (anodne zrake - ostaci atoma plina koji su se nalazili unutar žarulje i kojima je njihov elektron pukao zbog električnog pražnjenja). Postavljanjem električnog ili magnetskog polja izvan žarulje, te su se zrake skrenule prema negativnom polu. To je značilo da postoje pozitivne subatomske čestice, koje su nazvane protoni.
Kasnije, Ernest Rutherford (1871.-1937.) Izveo je pokus opisan u tekstu Rutherfordov atom, što ga je dovelo do otkrivanja mjesta protona: u jezgri.
- Neutroni: to su čestice s masom jednakom masi protona (1), ali kao što naziv govori, neutralne su, odnosno nemaju električni naboj.
Neutroni su otkriveni 1932 James Chadwick (1891-1974), koji su shvatili da jezgra radioaktivnog berilija emitira neutralne čestice s masom otprilike jednakom masi protona (zapravo, nešto je veća).
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Promjer jezgre ovisi o količini protona i neutrona koje ima atom, ali u prosjeku je oko 10-14 10. mjesec-15 m.
Atomska jezgra koncentrira praktički cijelu masu atoma, čineći vrlo mali dio: i proton i neutron su oko 100 000 puta manji od cijelog atoma! Usporedbe radi, zamislimo da povećavamo jezgru atoma elementa vodik (koji ima samo protona) do veličine teniske loptice, najbliži elektron bio bi udaljen oko tri kilometra udaljenost! Čak i kad bi atom bio uvećan do visine 14-kata zgrade, njegova bi jezgra bila veličina pukog zrna soli na sedmom katu. To je stvarno nešto nevjerojatno, zar ne mislite ?!
* Elektrosfera: Je područje gdje se elektroni okreću oko jezgre. Iako je područje mnogo većeg volumena od jezgre, praktički je prazno, jer je svaki elektron 1836 puta manji od 1 protona (ili od 1 neutrona). Zato je masa atoma praktički sva u jezgri. Elektroni su čestice s negativnim električnim nabojem (-1).
Elektroni su otkriveni 1897 Joseph John Thomson (1856. - 1940.), Tvorac Thomsonov atomski model. Thomsonov pokus može se detaljno vidjeti u tekstu Thomson-ov eksperiment s električnim pražnjenjima, ali ukratko, upotrijebio je spomenutu Crookesovu ampulu i shvatio da su katodne zrake uvijek privučen pozitivnim polom, koji je dokazao da atom ima negativne čestice, koje su tzv elektroni.
Elektroni se vrte oko jezgre milijardama puta u milijunti dio sekunde, oblikujući atom i tjerajući ga da se ponaša kao da je čvrst.
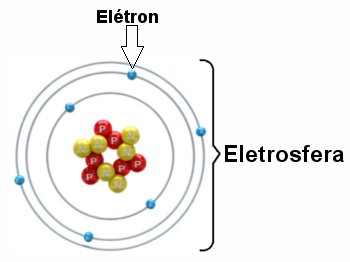
Prikaz elektrosfere s tri elektronička sloja i elektronima koji se okreću oko jezgre.
Ukratko, možemo napraviti tablicu za razlikovanje tri glavne subatomske čestice koje su dio strukture atoma:

Masa i električni naboj triju glavnih subatomskih čestica - protona, neutrona i elektrona
Atomi svih kemijskih elemenata sastoje se od ove tri subatomske čestice. Ono što razlikuje jedan kemijski element od drugog je količina u kojoj se te čestice pojavljuju, posebno količina protona u jezgri, koja se naziva atomski broj. Nastavite učiti o tome kroz tekst. Kemijski element.
* Moja misaona karta, Diogo Lopes
Napisala Jennifer Fogaça
Diplomirao kemiju
Kemija
Klasifikacija tvari, vode, cijanovodika, ugljičnog dioksida, amonijaka, vodika, helija, tvari jednostavne, složene tvari, smjese, faze smjese, homogena smjesa, smjesa heterogena.