U nastavku razmotrite generičku reverzibilnu reakciju, gdje mala slova odgovaraju uravnoteženim koeficijentima reakcije, a velika slova reaktanti, a svi su proizvodi plinoviti:

Uzimajući u obzir svaki od smjerova reakcija zasebno, njihove stope razvoja (Td) daju se:
* Izravna reakcija: aA + bB → cC + dD
svidirektno = Kdirektno. [THE]The. [B]B
* Obrnuta reakcija: cC + dD → aA + bB
sviinverzan = Kobrnuti. [Ç]ç. [D]d
Konstanta kemijske ravnoteže u smislu koncentracije u količini materije (Kç) i u smislu parcijalnog tlaka (KStr) dat će se dijeljenjem Kdirektno od Kobrnuti.
Tako imamo:
Kdirektno. [THE]The. [B]B = 1 → Kdirektno__ = __[Ç]ç. [D]d___
Kobrnuti. [Ç]ç. [D]d Kobrnuti [THE]The. [B]B
Biće, Kç =_Kdirektno_
Kobrnuti
Tako imamo:
Kç =__[Ç]ç. [D]d___ ili KStr =__(Praça)ç. (pD)d___ |
Gdje je p parcijalni tlak svake tvari u ravnoteži.
Na taj se način svaka koncentracija podiže na eksponent koji odgovara koeficijentu odnosne tvari u reakciji i Kç nema jedinicu *.
Uz to, vrlo važan aspekt koji treba istaknuti je onaj u ovom izrazu
ne smiju biti zastupljene niti čvrste komponente niti čiste tekućine., jer u ovom izrazu sudjeluju samo stvari koje mogu pretrpjeti promjene. Koncentracija količine tvari u krutom stanju tvari je konstantna i stoga je već uključena u vrijednost samog K.ç. Isto vrijedi i za čiste tekućine poput vode. Ukratko, u izražavanju sudjeluju samo tvari u plinovitom stanju i u vodenoj otopini.Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Primijetite primjere u nastavku:
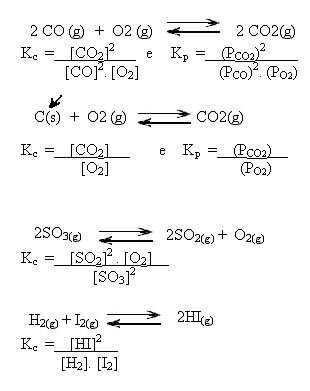
K vrijednostiç može nam pokazati jesu li koncentracije reaktanata i proizvoda jednake ili je jedan veći od drugog:
- ako Kç ili KStr jednak je jedinici (Kç = 1), to znači da je koncentracija reaktanata i proizvoda jednaka;
- ako je vrijednost od Kç ili KStr biti visok, to znači da su proizvodi u većoj koncentraciji, jer u izrazu Kç proizvodi su u brojniku;
- ako je vrijednost od Kç ili KStr je nisko, to znači da su reagensi u većoj koncentraciji, jer u izražaju Kç reagensi su u nazivniku.
* Kç i KStr to su bezdimenzionalni brojevi, to jest čisti brojevi, bez jedinice koja se odnosi na bilo koju veličinu ili odnos između veličina.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Konstante ravnoteže Kc i Kp"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Pristupljeno 28. lipnja 2021.