Neke anorganske funkcije ne dobivaju toliko pažnje u udžbenicima, pa čak ni tijekom nastave nekih učitelja, poput karbida i hidrida. U ovom tekstu, učinimo to drugačije, objasnit ćemo neke važne detalje o tzv. Anorganskoj funkciji hidrid.
Vas hidridi oni su binarni anorganski spojevi (imaju dva kemijska elementa) koji u svojoj strukturi predstavljaju vodikov element u pratnji bilo kojeg drugog kemijskog elementa. Najvažniji detalj je da vodik gotovo uvijek ima nox jednak -1, što ga u nekim hidridima čini najelektronegativnijim elementom. Voda (H2O) i amonijak (NH3) primjeri su koji izbjegavaju ovu pojavu.
Kako imenovati hidrid, pravilo imenovanja je vrlo jednostavno:
Hidrid+u+naziv elementa koji prati vodik
Pogledajte neke primjere hidridne nomenklature:
NaH = natrijev hidrid
KH = kalijev hidrid
CaH2 = kalcijev hidrid
AlH3 = aluminij-hidrid
SiH4 = silicijev hidrid
Vrlo su uobičajeni hidridi tri različite klasifikacije: ionski, molekularni i metalni. Pogledajte karakteristike svake od ovih vrsta:
a) Jonski hidrid:
Sadrži metalni element koji prati vodik. Najčešći metalni elementi su alkalijski, zemnoalkalijski metali (osim berilija i magnezija), galij, indij, talij i lantanidi.
Primjeri ionskih hidrida:
NaH = natrijev hidrid
KH = kalijev hidrid
CaH2 = kalcijev hidrid
Jonski hidridi imaju sljedeće značajke:
Čvrste tvari;
Visoko talište;
Provoditi električnu struju (kada je u tekućem stanju);
Većina se raspada prije postizanja točke topljenja;
Vrlo su reaktivni s vodom (u ovoj reakciji uvijek tvore anorgansku bazu popraćenu plinovitim vodikom). Pogledajte primjer ove reakcije:

Jednadžba reakcije natrijevog hidrida s vodom
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
b) Molekularni (ili kovalentni) hidrid
Oni su hidridi nastali kombinacijom vodika sa elementi iz skupina od 13 do 17 (obitelji: bor, dušik, halkogeni i halogeni). Elementi s niskom elektropozitivnosti, kao što su berilij i aluminij, čak i kao metali, tvore molekularne hidride.
Primjeri molekularnih hidrida:
AlH3 = aluminij-hidrid
SiH4 = silicijev hidrid
H2O = Hidrid kisika
Njegove glavne značajke su:
Mogu biti čvrste, tekuće ili plinovite;
Ne nose električnu struju;
Imaju nisko talište i vrelište;
Hlapivi su na sobnoj temperaturi;
Imaju slabe kemijske veze.
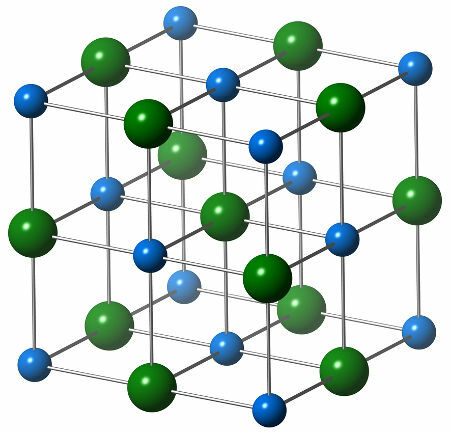
c) Metalni ili intersticijski hidrid
Hidridi koji imaju prijelazni metal (element koji predstavlja podnivo kao energičniju / B obitelj) slijedeći vodik. Nazivaju se intersticijima jer atom vodika često zauzima međuprostore u čvrstoj strukturi metala, kao u sljedećem prikazu:

atom vodika okružen atomima titana
Između glavne namjene hidrida, koji su čvrsti i dobri vodiči električne energije, imamo:
Skladištenje i transport krutog stanja vodika;
Hidridi aluminija i litija reduciraju u organskim sintezama (dodavanje vodika organskim spojevima);
Hidridi platine koriste se u organskim reakcijama halogeniranja (dodavanje atoma klora, fluora, broma ili joda) olefinima (alkeni, ugljikovodici s dvostrukom vezom).
Proizvodnja punjivih baterija;
Proizvodnja hladnjaka;
Izrada temperaturnih senzora.

Model temperaturnog senzora koji u svom radu koristi hidrid
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Hidridi"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/hidretos.htm. Pristupljeno 28. lipnja 2021.
Osnovna nomenklatura, vodena otopina, ionska disocijacija, kation, anion, natrijev hidroksid, aluminijski hidroksid, željezni hidroksid, bakreni hidroksid, željezni hidroksid, kalcijev hidroksid.