Da biste razumjeli fenomen ionizacija prvo je potrebno znati što su ioni. Obratite pažnju na objašnjenje u nastavku:
Svaki atom ima jednak broj protona i elektrona; stoga je svaki atom električki neutralan. Nadalje, tvari nastale skupinama atoma također imaju ravnotežu električnog naboja, budući da su električno neutralne.
Međutim, atom ili skupina atoma mogu izgubiti ili dobiti elektrone; kad se to dogodi, oni gube neutralnost i postaju ioni.
Ako atom ili skupina atoma izgubi elektrone, on će biti pozitivno nabijen i bit će nazvan ion kation. Međutim, ako dobijete elektrone, naboj će biti negativan, a ion će biti a anion.
Anorganske tvari su ionske ili imaju sposobnost stvaranja iona.
Jedan od načina stvaranja iona je stavljanjem molekularnih tvari u vodu, odnosno nastalih kovalentnim vezama, u kojima se dijele elektroni.
Na primjer, ako testiramo električnu vodljivost klorovodične kiseline (HCl) u vodenoj otopini (klorovodik otopljena u vodi), vidjet ćemo da je otopina elektrolitska, odnosno provodi električnu struju, jer u tome postoje ioni riješenje.

To znači da je voda djelovala kao reaktant, stvarajući ione iz klorovodične kiseline. To se događa prema reakciji u nastavku:
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
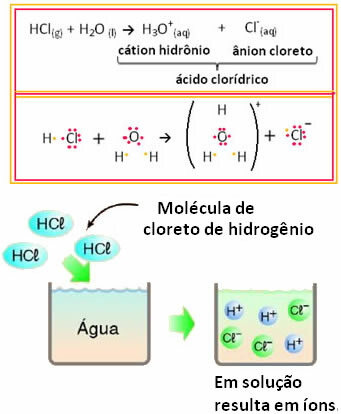
Imajte na umu da prije stavljanja klorovodika u vodu nije bilo iona. Međutim, njegove molekule su reagirale s vodom i stvorile pozitivne H ione3O+ (kationi) i negativi Cl- (anioni). Budući da je klor elektronegativniji od vodika, privlači par elektrona iz kovalentne veze u njegovoj blizini i stvara anion. Vodik, s druge strane, privlači kisik u vodi, koji je elektronegativniji od klora; a između vodika i kisika stvara se kovalentna veza koja daje kation hidronija. Ova pojava stvaranja iona se nazivaionizacija.
Na temelju gornjeg objašnjenja ionizaciju možemo definirati na sljedeći način:

Imajte na umu da ioni prije nisu postojali, jer da jesu, kao u slučaju otapanja ionskih spojeva, imali bismo ionsku disocijaciju, a ne ionizaciju.
Sve kiseline dovedene u kontakt s vodom prolaze ionizaciju. Međutim, nije svaki molekularni spoj podvrgnut ionizaciji.Na primjer, šećer (C12H22O11) je molekularan, međutim, kad se stavi u vodu, ne stvaraju se ioni, on se samo otapa, stvarajući neelektrolitičku molekularnu otopinu koja ne provodi električnu energiju.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. „Jonizacija“; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/ionizacao.htm. Pristupljeno 28. lipnja 2021.

