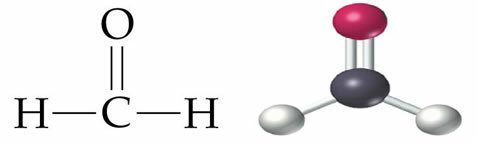Molekularni spojevi ili kovalenti nastaju kroz kovalentne veze, oni u kojima nemamo udjela metala (s izuzetkom berilija) u njihovoj tvorbi. Dakle, u ovoj vrsti veze svi atomi trebaju primiti elektrone i, prema tome, uvijek će ih dijeliti.
THE strukturna formula je jedan od načina koji se koristi za predstavljanje dijeljenja elektrona između atoma molekularnih spojeva. Da bismo mogli provesti sastavljanje strukturne formule, potrebno je da prije svega znamo koja je potreba za svakim od elemenata koji su uključeni u spoj prema teorija okteta. Tablica u nastavku prikazuje potrebu za svakim uključenim elementom prema svojoj obitelji:

Iz gore izraženih potreba, to bismo trebali znati izgraditi strukturnu formulu, kao resurse imamo samo sljedeće alate:
• jednostruka veza: - (dijeljenje dva elektrona);
• dvostruka veza: = (dijeljenje četiri elektrona);
• trostruka veza: ≡ (dijeljenje šest elektrona);
Poznavanje potreba i alata, sastavljanje strukturne formule molekularnog spoja može se izvesti iz sljedećeg koraka po koraka:
a) Dijatomska molekula (koju čine samo dva atoma):
Samo napišite atom s lijeve strane i atom s desne strane i postavite vezu koja odgovara potrebama oba. Pogledajte nekoliko primjera:
- O2
Kako kisik pripada obitelji VIA, potrebna su mu dva elektrona. Stoga je veza koja najbolje odgovara među njima dvostruka veza.

- HCl
Budući da H i Cl trebaju samo jedan elektron, veza koja najbolje odgovara njima je jednostavna.

b) Molekule koje imaju više od dva atoma
U molekularnim spojevima koji imaju više od dva atoma, u središte molekule moramo postaviti atom koji treba najveći broj veza (prioritet) ili najmanje elektronegativni atom. Ostali moraju biti na četiri pola (sjeverni, južni, istočni i zapadni). Kada postavljamo vezu između svakog od njih, moramo dati prioritet atomima koji su na polovima. Središnji atom uvijek će biti stabiliziran slijedeći ovaj redoslijed okupljanja. Pogledajte nekoliko primjera:
- H2O
Kako kisiku treba više veza (dvije, jer pripada obitelji VIA), bit će postavljen u središte molekule, a vodikovi na polovima. Kako je potreba za svakim H samo jedna veza za svakog od njih, poslužit ćemo se jednostavnom vezom. Budući da će kisik stvoriti dvije jednostruke veze, on će biti stabilan.

Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
- NH3
Budući da dušiku treba više veza (tri, jer pripada obitelji VA), bit će postavljen u središte molekule, a vodikovi na polovima. Kako je potreba za svakim vodikom samo jedna veza za svakog od njih, koristit ćemo jednostruku vezu. Budući da će kisik stvoriti tri jednostruke veze, on će biti stabilan.

- CH4
Kako ugljiku treba više veza (četiri, kao što je iz obitelji VIA), bit će postavljen u središte molekule, a vodikovi na polovima. Kako je potreba za svakim vodikom samo jedna veza za svakog od njih, koristit ćemo jednostruku vezu. Budući da će ugljik stvoriti četiri pojedinačne veze, on će biti stabilan.

- CO2
Budući da ugljiku treba više veza (4, jer pripada obitelji IVA), bit će postavljen u središte molekule, a kisik na polovima. Budući da je potreba za svakim O dvije veze za svaku od njih, koristit ćemo dvostruku vezu. Budući da će kisik stvoriti dvije dvostruke veze, on će biti stabilan.

Promatranje: Kada je atom molekule, tijekom sastavljanja strukturne formule, stabilan i još jedan treba od dva elektrona, možemo koristiti različit alat, koji se naziva koordinatna kovalentna veza dativ. Ova vrsta veze može se koristiti samo pod ovim uvjetima (jedan atom je stabilan, a drugi treba dva elektrona). Pogledajte nekoliko primjera:
- CO
Budući da imamo samo dva atoma, stavimo jedan s lijeve, a drugi s desne strane. Kisik trebaju dvije veze, pa moramo koristiti dvostruku vezu.

Međutim, kada se koristi par, kisik je stabilan i ugljiku su potrebna još dva elektrona. Stoga se možemo poslužiti dativnom kovalentnom vezom koja je predstavljena strelicom koja uvijek ide od stabilnog atoma do nestabilnog atoma.

- O3
Kako imamo tri atoma, jedan od kisika mora biti u središtu molekule, a druga dva u polovima. Pravilo koje se proučava uvijek traži da u tim slučajevima prvo stavimo veze na atome na polovima. Međutim, ovdje možemo dodati samo jedan dvostruki, jer svi kisika stvaraju samo dvije veze.

Kisik u središtu je stabilan, dok kisiku u lijevoj strani trebaju još dva elektrona. Iz tog razloga možemo koristiti dativnu vezu da bismo je stabilizirali.

Ja, Diogo Lopes Dias