Metali su elementi koje karakterizira svjetlina, čvrstoća, toplinska i električna vodljivost. Oni su primjenjiv u gotovo svim industrijskim procesima, prisutni u metalnim legurama koje se koriste u proizvodnji alata, nakita i kovanog novca te u kemijskim procesima kao što je redoks, odgovorni za rad hrpe i baterije.
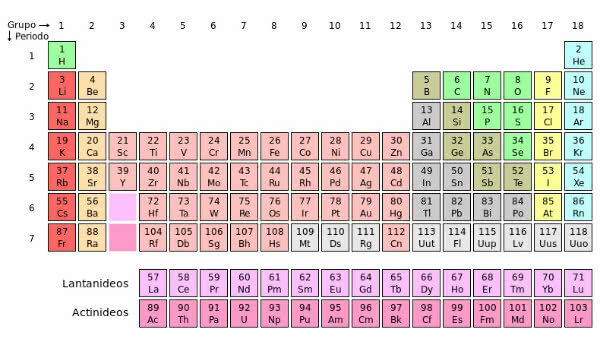
U periodnom sustavu klasificirani su na:
polumetal
prijelazni metali
alkalni metali
zemnoalkalijski metali
U industriji čelika podijeljeni su na:
crni metali
obojeni metali
teški metali
Pročitajte i vi: Koji su novi elementi periodnog sustava?
Karakteristike metala

Oni su uglavnom izvrsni provodnici topline i električne energije.
Imaju sjajni izgled.
imaju visoku gustoća.
Oni su elektropozitivni elementi (imaju tendenciju da tvore katione - pozitivne naboje).
S izuzetkom Merkur, oni su elementi s visokim talištem i čvrsti na sobnoj temperaturi.
Imaju mehaničku čvrstoću (žilavost).
Oni su podatni (mogu se oblikovati bez lomljenja).
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Metali periodnog sustava
alkalni metali
Jesu li elementi prvi stupac periodnog sustava, obitelj 1A. Oni se nazivaju alkalnim metalima jer, kad se pomiješaju s vodom, tvore hidrokside, odnosno alkalnu (baznu) otopinu.
Vas elementi koji pripadaju ovoj skupini su:
Litij (li)
Natrij (Na)
Kalij (K)
Rubidij (Rb)
Cezij (Cs)
Francio (Fr)
Elektronička konfiguracija alkalnih metala u neutralnom (nenapunjenom / ioniziranom) stanju predstavlja samo elektron u posljednjoj ljusci (valentni sloj). O atomska zraka a reaktivnost tih metala raste od vrha do dna (promatrajući Periodni sustav elemenata). Imaju nisku točku topljenja u usporedbi s drugim metalima, podatni su i nisu vrlo gusti, imaju mat izgled zbog visok oksidacijski potencijal.
Pogledajte i:Koja su svojstva materije?
zemnoalkalijski metali
To su elementi koji se pojavljuju u drugi stupac periodnog sustava, obitelj 2A. se zovu zemno alkalna tendencijom stvaranja otopina osnovnog (alkalnog) karaktera i zemljom jer su prije 19. stoljeća tako označeni oksidi nastali tim tvarima. Ovim se pojmom označavali netopljivi metali koji nisu podvrgnuti mutaciji zagrijavanjem, zajedničke karakteristike elemenata skupine 2. Kasnije je, u svjetlu novih istraživanja i eksperimenata, otkriveno da su elementi "zemlje" zapravo oksidi nastali metalima.
Oni su kovljivi metali, s niskom gustoćom dva elektrona u svojoj najudaljenijoj ljusci, nalaze se, u normalnim uvjetima temperature i tlaka, u krutom stanju. Pripadaju ovoj grupi:
Berilijum (Biti)
Magnezij (Mg)
Kalcij (Ovdje)
Stroncij (g.)
Barij (Ba)
Radio (Žaba)
prijelazni metali
čine skupina B Periodnog sustava, i nalaze se između zemnoalkalijskih metala i ametali. IUPAC ih je definirao kao elemente koji imaju nepotpuni energetski podsloj. Uvjet "prijelazni metali" odnosi se na prijelaz iz grupe 2 u 13 u Periodnom sustavu i sve veći dodatak elektrona u orbitali 'd'.
Skupina prijelaznih metala sastoji se od gustih elemenata, s visokim talištima i vrelištima, i manje reaktivni od metala skupine 1 i 2 (Obitelj 1A i 2A). Među prijelaznim metalima su volfram koji je element s najvišom tačkom topljenja (3422 ° C) i živa (Hg) koji je metal koji je u normalnim uvjetima temperature i tlaka tekući, temperatura topljenja mu je (-38,83 ° C).
Prijelazni metali imaju različita oksidacijska stanja (NOX varijabilna) i tvore obojene tvari.

Unutarnji prijelazni elementi
Unutarnji prijelazni elementi oni su:
Lantanidi: serije sastavljene od elemenata koji imaju od 57 do 71 protona i koji su, osim prometija, prirodni.
Aktinidi: skupina koju čine elementi u atomskom broju od 89 do 103 i koji su, uglavnom, sintetički. Sva je ova skupina radioaktivni s kratkim poluvijekom.
Elementi ove dvije skupine imaju visoko talište i svi su čvrsti na sobnoj temperaturi.
Polu metali
Vas polumetal postoji, ukupno, sedam elemenata:
Bor (B)
Silicij (Si)
Germanij (ge)
Arsen (kao)
Antimon (Ponedjeljak)
Telur (Te)
Polonij (Po)
Ova se klasifikacija daje elementima koji imaju fizikalno-kemijske značajke značajne za metale, a također i druge značajne za nemetalne elemente. Semimetali imaju sjaj, krhki su spojevi, sposobni stvarati katione kao i anione (ovisno o stanju) i međuprovodnici su.
Vrste metala
Željezni: tvari koje u svom sastavu sadrže željezo. Oni su metalne legure koji sadrže željezo kao zajednički element, ali se mogu formulirati s različitim koncentracijama ugljik, na primjer, ili kovani različitim tehnikama, tako da imaju proizvode s različitim fizičkim svojstvima.
Obojena: legure nastale drugim vrstama metala, kao što su aluminij, bakar, nikla, cinkov, titan.
Teški metali: olovo, nikal, cink, živa. Oni su reaktivni, otrovni i bioakumulativni metali. Koriste se, među ostalim, u baterijama, svjetiljkama, streljivu za ratne predmete.
Kemijske veze metala
Metali jesu elementi elektropozitivan, odnosno imaju tendenciju gubljenja elektrona u kemijskoj vezi. Kada metal stupi u interakciju s nemetalom, on vrši ionsku vezu zbog razlike u elektronegativnost. Druga mogućnost vezivanja za metale su metalne veze.
Na metalne veze javljaju se između metala, s djelomičnim oslobađanjem elektrona i stvaranjem oblaka ili mora elektrona oko atoma, što metalnim dijelovima jamči svojstva provodljivost električna i podatnost.
Pogledajte i: Provodnici i izolatori - koje su razlike?
Dobivanje metala
Većina metala nalazi se prirodno u stijene i minerali povezani s drugim elementima. Postoji nekoliko tehnika za pročišćavanje metala, poput elektrolize i kemijskih reakcija na zasebne spojeve.
U slučaju metala, dvije najčešće korištene tehnike u industrijskim razmjerima za postizanje određenog stupnja čistoće u metalu su: razlika od gustoća i magnetska osjetljivost (tendencija da metal mora reagirati na a magnetsko polje).

Riješene vježbe
Pitanje 1 - (Enem) Kadmij, prisutan u baterijama, može doći do tla kada se ti materijali neredovito odlažu u okoliš ili kad se spaljuju. Za razliku od metalnog oblika, ioni Cd2 + izuzetno su opasni za tijelo jer mogu nadomjestiti Ca2 + ioni uzrokuju degenerativnu bolest u kostima, čine ih vrlo poroznima i uzrokuju jake bolove u kostima. zglobovima. Oni također mogu inhibirati enzime aktivirane kationom Zn2 +, koji su izuzetno važni za rad bubrega. Slika prikazuje varijacije u radijusu nekih metala i njihovih kationa.
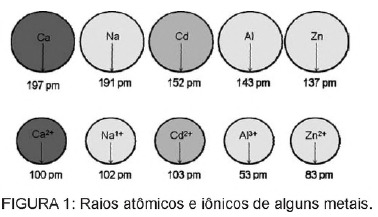
Na temelju teksta, toksičnost kadmija u ionskom obliku posljedica je ovog elementa
A) prisutna je niska energija ionizacije, koja pogoduje stvaranju iona i olakšava njegovo vezanje na druge spojeve.
B) imaju tendenciju djelovanja u biološkim procesima posredovanim metalnim kationima s nabojima u rasponu od +1 do +3.
C) imaju radijus i naboj relativno blizu iona metala koji djeluju na biološke procese, uzrokujući smetnje u tim procesima.
D) imaju velik ionski radijus koji mu omogućuje miješanje u biološke procese u kojima manji ioni normalno sudjeluju.
E) imaju +2 naboj, što mu omogućuje da interferira s biološkim procesima u kojima, normalno, sudjeluju ioni s nižim nabojima.
Razlučivost
Alternativa C. Kadmij je element sličan metalnim ionima koje prirodno imamo u tijelu. Osim što se kadmij može bioakumulirati, ima sličnost s metalnim skupinama, može se vezati i za sulfhidrilne skupine molekula proteina, uzrokujući tako promjene u biološkim procesima, poput dekalcifikacije, i uništavanju tkiva i crvenih krvnih stanica krv.
Pitanje 2 - Za karakteristike relevantne za metale, označite netočnu alternativu.
A) Većina metala su dobri električni i toplinski vodiči.
B) Neki su metali osjetljivi na oksidaciju i / ili redukciju.
C) Željezo je otporan i kovan metal, odnosno lako ga je oblikovati.
D) Zemnoalkalijski metali imaju ovaj naziv "zemlja" koji se odnosi na okside tih metala koji su tamne boje.
E) Metali su elementi različitih boja i bez sjaja zbog djelovanja oksidacije.
Razlučivost
Alternativa E. Metali su prirodno sjajni i metalne boje, mogu podvrgnuti oksidaciji, što uzrokuje promjene karakteristika značajnih za aspekt dijela, ali to nije pojava koja se događa kod svih metala, au nekim slučajevima oksidacija ovisi o nekoliko čimbenika vanjski.
Laysa Bernardes
Učitelj kemije