Postoji grana znanosti koja proučava brzinu kemijskih reakcija i čimbenike koji na nju utječu, naziva se Kemijska kinetika. Kemijske reakcije mogu se definirati kao skup pojava u kojima dvije ili više tvari međusobno reagiraju, što dovodi do različitih spojeva. Kemijska jednadžba je grafički prikaz kemijske reakcije, gdje se reaktanti pojavljuju u prvom članu, a proizvodi u drugom.
A + B  C + D
C + D
Reagensi Proizvodi
Znanje i proučavanje reakcija, osim što je vrlo važno u industrijskom smislu, također je povezano s našim svakodnevnim životom.
Brzina reakcije je koliko brzo se reaktanti troše ili koliko brzo nastaju proizvodi. Izgaranje svijeće i stvaranje hrđe primjeri su sporih reakcija. U dinamitu je razgradnja nitroglicerina brza reakcija.
Brzine kemijskih reakcija određuju se empirijskim zakonima, koji se nazivaju zakonima brzina, zaključeno iz utjecaja koncentracije reaktanata i proizvoda na brzinu reakcija.
Kemijske reakcije događaju se različitim brzinama i one se mogu mijenjati, jer se osim koncentracije reaktanata i proizvoda, brzine reakcije također ovise o drugim čimbenicima Kao:
Koncentracija reagensa: što je veća koncentracija reaktanata, reakcija će biti brža. Da bi se odvijala reakcija između dvije ili više tvari, potrebno je da se molekule sudare, tako da dolazi do prekida veza s posljedičnim stvaranjem novih. Broj sudara ovisit će o koncentracijama A i B. Pogledajte sliku:
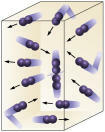
Molekule se češće sudaraju ako
povećavamo broj reakcijskih molekula.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Lako je vidjeti da će zbog veće koncentracije doći do povećanja sudara između molekula.
kontaktna površina: povećanje kontaktne površine povećava brzinu reakcije. Primjer je kada otopimo zdrobljenu tabletu sonrisal i ona se brže otopi nego da je cjelina, to se događa jer povećavamo kontaktnu površinu koja reagira s Voda.
Pritisak: kada povećavate tlak u plinovitom sustavu, brzina reakcije se povećava.
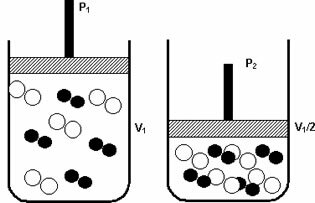
Porast tlaka s P1 na P2 smanjio je volumen s V1 na V1 / 2, ubrzavajući reakciju zbog približavanja molekula.
Gornja slika prikazuje, jer će smanjenjem volumena u drugom spremniku doći do povećanja pritisak koji pojačava sudare molekula i kao posljedicu povećanje brzine reakcija.
Temperatura: kada se temperatura sustava poveća, dolazi i do povećanja brzine reakcije. Povećanje temperature znači povećanje kinetičke energije molekula. Svakodnevno možemo uočiti ovaj čimbenik dok kuhamo i povećavamo plamen štednjaka tako da hrana brže postiže stupanj kuhanja.
Katalizatori: Katalizatori su tvari koje ubrzavaju mehanizam bez trajnog mijenjanja, tj. Tijekom reakcije se ne troše. Katalizatori omogućuju reakciji alternativni put, koji zahtijeva manje energije za aktiviranje, što dovodi do bržeg odvijanja reakcije. Važno je zapamtiti da katalizator ubrzava reakciju, ali ne povećava prinos, odnosno proizvodi istu količinu proizvoda, ali u kraćem vremenskom razdoblju.
Napisala Líria Alves
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
SOUZA, Líria Alves de. "Kemijska kinetika"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm. Pristupljeno 27. lipnja 2021.



